
Acasă | Despre noi | feedback-ul
Există două tipuri principale de energie - cinetică (datorită mișcării corpului) și potențial (datorită poziției corpului sau a părților sale în spațiu). Aceste două tipuri de energie se manifestă în diferite forme, de exemplu, sub formă de căldură (căldură), lumină (energie de radiație), energie chimică, electrică sau în alte forme.
Conform legii conservării energiei. energia nu este creată din nimic și nu este distrusă, ci poate fi transferată de la un corp la altul sau transformată dintr-o formă în alta. În consecință, dacă energia unui anumit tip dispare în timpul procesului, în schimb se produce o cantitate echivalentă de energie de alt fel. Aplicăm idei despre conservarea energiei în sistemele chimice.
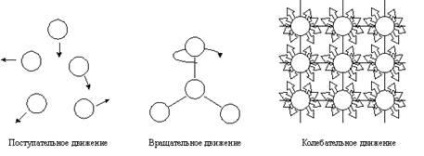
Fig. 4.1. Tipuri de mișcare mecanică.
Atomii, moleculele sau ionii care alcătuiesc un sistem chimic au energie cinetică și potențială. Energia cinetică se datorează mișcării particulelor. Această mișcare poate fi translațională, rotativă și oscilantă (figura 4.1).
Un fel de energie cinetică este căldura. deoarece este asociată cu mișcarea atomilor și a moleculelor. Energia potențială a particulelor se datorează interacțiunii dintre ele. De exemplu, electronii dintr-un atom au energie potențială în ceea ce privește sarcinile pozitive din nucleul său. Energia de legare este, de asemenea, una dintre formele de energie potențială. Ruptura și formarea legăturilor chimice sunt însoțite de o schimbare a potențialului de energie, deoarece legăturile chimice din produsele de reacție și din materiile prime pot să difere substanțial.
Suma energiilor potențiale și cinetice ale tuturor particulelor din sistem (în afară de energiile cinetice și potențiale ale sistemului ca întreg) se numește energia internă a sistemului (U). Valoarea absolută a U nu poate fi determinată, deoarece este imposibil să aducem sistemul într-o stare lipsită de energie.
Energia internă este o funcție a stării sistemului, astfel încât schimbarea sa (DU) este determinată de expresia:
Schimbarea energiei interne a sistemului apare când energia este transferată către sau din sistem. Există două modalități principale de transfer de energie: transferul de căldură și performanța muncii. Transferul de energie cauzat de diferența de temperatură dintre sistem și mediul său sau între un sistem și alt sistem se numește transferul de căldură. Cantitatea de energie transmisă în acest mod este notată cu litera Q (J) și este egală cu:
unde m este masa sistemului (kg),
DT - schimbarea temperaturii (K),
C este căldura specifică a substanței din care este compus sistemul (J / (kg · K)).
Căldura nu este o proprietate a sistemului, deci nu poate fi o funcție a stării sistemului.
O altă formă de transfer de energie este lucrarea - W (J). Există diferite tipuri de muncă. În chimie, munca este asociată cel mai adesea cu extinderea sistemului. O astfel de expansiune apare atunci când gazul este eliberat în timpul reacției. În acest caz, munca efectuată de sistem este determinată de expresia:
unde P este presiunea externă (Pa), pentru multe reacții chimice presiunea externă este egală cu presiunea atmosferică;
DV = V2 - V1 - modificarea volumului sistemului (m 3).
Astfel, schimbarea energiei interne (DU) a unui sistem închis este egală cu diferența dintre căldura Q comunicată sistemului și activitatea pe care o face în acel moment, adică
Relația rezultată este numită prima lege a termodinamicii. Această lege este una dintre formulările legii conservării energiei. deoarece arată că schimbarea energiei interne a sistemului (DU) este asociată numai cu transferul de energie către sau de la sistem.
4.4.1. EFECTUL TERMIC AL REACȚIEI CHIMICE. enthalpy
De obicei, reacțiile chimice sunt însoțite de efecte termice. Efectul termic este cantitatea totală de energie eliberată sau absorbită de sistem ca urmare a unei reacții efectuate la o temperatură constantă. Secțiunea de chimie care studiază efectele termice ale reacțiilor chimice și ale transformărilor de fază se numește termochimie.
Conform primei legi a termodinamicii (ecuația 4.6), cantitatea de căldură eliberată sau absorbită de sistemul Q este determinată de ecuația:
Înlocuind expresia (4.5) în (4.6), obținem egalitatea:
determinarea efectului termic al unei reacții chimice. Rezultă din (4.7) că efectul termic al reacției depinde de condițiile în care are loc. În procesul izocoric V = const, DV = 0, prin urmare, efectul termic al reacției QV este egal cu schimbarea energiei interne a sistemului:
Enthalpia, precum și energia internă, reprezintă o funcție termodinamică a stării sistemului.
Pentru reacțiile în care participă numai substanțele solide și lichide, termenul p · DV din ecuația (4.10a) este neglijabil sau zero. Pentru astfel de reacții, relația DH »DU este îndeplinită. Pentru reacțiile în fază gazoasă care implică substanțe gazoase, modificarea volumului este semnificativă. Dacă DV> 0, adică există o extensie, apoi DH> DU; dacă DV <0, т.е. происходит сжатие, то DH unde Dn este schimbarea numărului de moli de gaz, determinată din ecuația de reacție; de exemplu, Reacțiile chimice care au loc cu eliberarea căldurii sunt numite exoterme. În același timp, în procesul izocoric, energia internă a sistemului scade; DU <0 (т.к. U2 Fig. 4. Schimbarea entalpiei sistemului: a) în exotermă; b) reacții endoterme. Reacțiile chimice care au loc prin absorbția căldurii sunt numite reacții endoterme. În procesul de izocoră DU> 0, în procesul izobară - DH> 0. Scăderea entalpie proceselor exotermice este că energia totală conținută în produsele de reacție sub formă de energie de legături chimice, interacțiuni intermoleculare, vibratii moleculare etc. Mai puțin decât energia totală a materiilor prime (reactivi). Dimpotrivă, o creștere a entalpiei în procesele endotermice înseamnă că energia totală conținută în produsele de reacție este mai mare decât energia totală a materiilor prime. Schimbarea entalpiei cu starea standard a substanțelor. (T) și DH ° (298 K), dacă temperatura sistemului este T sau 298,15 K. Efectele termice ale reacțiilor chimice depind nu numai de condițiile (temperatura, presiunea, volumul) în care acestea apar, ci și de cantitatea de substanțe implicate în reacție și de starea lor fizică. Prin urmare, pentru a putea compara efectele diferitelor procese energetice caracterizează le schimbă entalpie în condiții standard corespunzătoare unei ecuații de reacție chimică specifică. Ecuațiile reacții chimice, care sunt efectele lor termice și stări de agregare (z-gaz, lichid tren la cristalin, t-solid) sau de modificare a alotropic (de exemplu-un atom de sulf, b-sulf) substanțe, numite ecuații de reacție termochimice . De exemplu: 4.4.2. DREPTURI TERMO-CHIMICE. CALCULĂRI TERMOCHIMICE Efectele termice ale reacțiilor chimice pot fi determinate experimental sau prin calcul. Măsurarea efectelor termice se numește calorimetrie. În centrul calculelor termochemice este legea formulată de cercetătorul rus G.I. Hess (1840): Dezvoltarea energiei reiki-spirituale - sistemul tradițional de lamele Epilepsia - boli netransmisibile - boli ale organelor și sistemelor interne - sistemul nervos Vaginita - boli netransmisibile - boli ale organelor și sistemelor interne - sistemul reproductiv
Articole similare
Trimiteți-le prietenilor: