INSTRUCȚIUNI privind utilizarea medicamentelor de uz medical
(Vaccinul împotriva varicelor vii atenuat)
Număr de înregistrare: LSR-001354/08
Denumire comercială: Varilrix® / Varilrix®.
Denumire internationala neprotejata sau chimica: Vaccin pentru prevenirea varicelor.
Forma farmaceutică: liofilizată pentru prepararea unei soluții pentru administrare subcutanată. 1 doză / completă cu un solvent - apă pentru injectare.
Varilriks® - vaccinul viu atenuat pentru prevenirea varicelei, este un virus viu atenuat Varicella Zoster (tulpina Oka) au fost cultivate în cultura MRC-5 celule diploide umane.
Varilrix® îndeplinește toate cerințele Organizației Mondiale a Sănătății pentru producerea medicamentelor imunobiologice medicale.
COMPOZIȚIE (1 doză de inoculare - 0,5 ml)
Componentă activă: virus viu atenuat Varicella Zoster (tulpina Oka) 103 3 unități de formare a plăcilor (PFU).
Excipienți: albumină serică umană - stabilizator 1 mg, neomicină
sulfat mai mic de 25 pg, lactoză 32 mg, sorbitol 6 mg, manitol 8 mg. aminoacizi 8 mg.
Solvent: apă pentru injectare 0,5 ml.
De la o culoare amorfă sau pulbere de culoare galbenă cremoasă până la galben deschis.
GRUPUL FARMACO-TERAPEUTIC: MIBP este un vaccin.
Codul ATX: J07BK01.
Introducerea vaccinului Varilrix® provoacă producerea de anticorpi împotriva virusului varicelo-zoster, oferind protecție specifică împotriva acestei infecții. Un anumit grad de protecție poate fi obținut prin imunizare timp de până la 72 de ore după expunerea la virusul Varicella Zoster. Titrul de anticorpi ≥1 / 4: stabilit prin metoda NERIF, este considerat protector.
Aproape toți copiii sănătoși cu vârsta cuprinsă între 9 luni la 12 ani și șase săptămâni de la vaccinare a fost determinată de nivelul de protecție, care a fost menținută timp de cel puțin 7 ani după vaccinare.
Cu toate acestea, copiii care au primit 1 doza de vaccin Varilriks' într-o perioadă mai mare de 42 de zile după vaccinare au fost înregistrate cazuri izolate de boli cauzate de tulpina sălbatică a Varicella Zoster. Introducerea celei de-a doua doze previne în mod eficient cazurile de infecție cu vierme de pui. Toți copiii sub vârsta de 13 ani după vaccinare dublu a avut un nivel pronunțat de protecție, care a fost menținută timp de cel puțin un an (în timpul observației într-un studiu clinic). Studiile clinice au arătat că majoritatea vaccinată, care au fost ulterior în contact cu bolnavi sau nu este susceptibil la infecție sau boală este transferată într-o formă mult mai ușoară (mai puține leziuni, fără febră).
Pacienți din grupuri cu risc crescut
Variculă este un factor important de risc care agravează cursul și prognosticul unei boli severe existente la următoarele grupuri de pacienți:
- pacienți cu leucemie acută; pacienții tratați cu terapie imunosupresoare, inclusiv utilizarea corticosteroizilor; pacienții care urmează să fie supuși unei operații de transplant:
- pacienții care suferă de boli cronice severe, cum ar fi tulburări metabolice și endocrine, boli pulmonare cronice si sistemul cardiovascular, fibroza chistica si tulburari neuromusculare;
• persoane sănătoase care sunt în contact strâns cu cei bolnavi sau cu risc crescut, care nu au avut vierme de pui și care nu au fost vaccinați înainte
Pacienții din grupele de mai sus tratate cu medicamente imunosupresoare (inclusiv corticosteroizi) pentru tumori solide maligne sau pentru boli grave cronice (insuficiență renală, boli autoimune, boli ale țesutului conjunctiv sistemic, astm sever), predispusi la varicela boala in forma severa. La pacienții cu risc crescut trebuie sa efectueze periodic determinarea titrurilor de anticorpi la virusul varicella pentru o decizie privind necesitatea unor vaccinări suplimentare.
- Profilaxia de rutină a varicelei de la 12 luni, în primul rând la persoanele clasificate ca fiind de mare risc, care nu au suferit de varicela și care nu au fost vaccinate înainte.
• Prevenirea de urgență a varicelei la persoanele fara antecedente de varicela si nu vaccinate anterior, au fost în contact apropiat cu variola bolnav de pui (membri de familie, medici, personalul medical de mijloc și de juniori, precum și altele).
- Hipersensibilitate la orice component al vaccinului, inclusiv neomicină; simptome de hipersensibilitate la administrarea anterioară a vaccinului Varilrix *.
• imunodeficiență primară sau dobândită (care sa dezvoltat datorită leucemie, limfom, sânge discrazii, manifestările clinice ale infecției cu HIV, utilizarea de medicamente imunosupresoare, incluzând terapia cu corticosteroizi în doze mari), definită de numărul de limfocite - mai mult de 1200 de limfocite / mm3, iar prezența altor caracteristici de imunodeficiență celulare.
• Bolile acute infecțioase și neinfecțioase, exacerbarea bolilor cronice reprezintă contraindicații temporare pentru vaccinare; cu infecții virale respiratorii acute fără boli acute, boli intestinale acute, vaccinările se efectuează imediat după normalizarea temperaturii.
• Sarcina sau sarcina planificată în decurs de trei luni. Perioada alăptării.
Ca și în cazul administrării parenterale a oricărui alt vaccin, ar trebui să fie gata tot ce este necesar pentru a opri o reacție anafilactică posibilă la Varilrix®. Vaccinatul ar trebui să fie sub supraveghere medicală timp de 30 de minute după imunizare. Trebuie luate măsuri contraceptive adecvate în termen de trei luni de la vaccinare cu Varilrix®. În prezența imunodeficienței primare sau dobândite vaccinarea se efectuează după determinarea numărului de limfocite. Varilrix * nu trebuie administrat intradermic și în niciun caz nu trebuie administrat intravenos. La pacienții care primesc terapie masivă cu imunosupresoare, după vaccinare se pot dezvolta semne clinice de varicela.
METODA DE UTILIZARE ȘI DOSE
Vaccinul Varilrix® este destinat administrării subcutanate. Pentru prepararea unei soluții injectabile conținutul fiolei trebuie mutate cu solventul sau seringii în flaconul cu liofilizat, suspensia rezultată a fost agitată bine până la dizolvarea completă a liofilizatului (aproximativ 3 minute) și apoi formați în seringă din nou. Pentru a introduce soluția pregătită, trebuie utilizat un ac nou. Soluția amestecată a fost transparentă galben-roz la culoare roz, și un precipitat fără incluziuni străine vizibile. Înainte de introducerea vaccinului, conținutul trebuie să fie examinat pentru materii străine și modificarea aspectului. Dacă vaccinul a descoperit o abatere de la normă, atunci acest pachet este supus la distrugere. Site-ul preferat de administrare a vaccinului Varilriks * - umăr regiunea deltoid după prelucrarea locul de injectare cu alcool sau alte substanțe utilizate pentru dezinfectare, trebuie să aștepte până când substanța activă se evaporă, deoarece contactul cu acești compuși se pot produce inactivarea virusului din vaccin. Vaccinul trebuie administrat imediat după diluare cu un solvent.
1 doză de vaccin (0,5 ml) de două ori. Intervalul minim recomandat între vaccinuri trebuie să fie de 6 săptămâni.
Vaccinarea grupurilor cu risc ridicat
Pacienți cu leucemie acută, pacienți cu boli cronice severe și pacienți tratați cu terapie imunosupresoare și cu radioterapie Imunizarea se efectuează într-o stare de remisie hematologică completă. În acest caz, este necesar să se asigure că numărul total de limfocite nu este mai mic de 1200 / mm3 și, de asemenea, nu există simptome care să indice insuficiența imunității celulare. Dacă vaccinarea este planificată în faza acută de leucemie, chimioterapia trebuie întreruptă pentru o perioadă de o săptămână înainte și o săptămână după vaccinare. Nu vaccinați în timpul perioadelor de radioterapie. Pacienții care sunt programate pentru a efectua transplantul de organe Dacă pacienții cu transplant de organe să fie, cursul de vaccinare trebuie completat cu câteva săptămâni înainte de începerea tratamentului, imunosupresori, pacienții cu risc ridicat pot necesita doze suplimentare de vaccin. Decizia privind necesitatea introducerii unor doze suplimentare de vaccin Varilrix "este luată de medicul curant (imunohematolog, oncolog, transplantolog).
Vaccinarea se efectuează o dată cu o doză de vaccin (0,5 ml) în primele 96 de ore după contact (de preferință în primele 72 de ore).
Interschimbabilitatea vaccinurilor Varilrix® poate fi introdusă persoanelor care au fost deja vaccinate cu un alt vaccin pentru prevenirea varicelor. Cursul de vaccinare cu varicela inițiat de vaccinul Varilrix® poate fi continuat cu un alt vaccin împotriva varicelei.
Infecții și infestări rare: infecții ale tractului respirator superior, faringită
Din sistemul hemopoietic și limfatic Frecvent: limfadenopatie Tulburări de la psihic Infecție: iritabilitate
Din partea sistemului nervos Foarte frecvente: dureri de cap, somnolență
Din organele de vedere Rare: conjunctivită
Din organele respiratorii, toracice și mediastinale Foarte frecvente: rinită, tuse
Din tractul gastro-intestinal Foarte rar: greață, vărsături Rar: durere în regiunea abdominală, diaree
Din sistemul musculo-scheletic și din țesutul conjunctiv rare: artralgie, mialgie
Afecțiuni cutanate și ale țesutului subcutanat Frecvente: orice erupții cutanate, nu sunt vizual similare cu vezikulezom cauzate de virusului varicelo-zosterian Mai puțin frecvente: erupții cutanate, erupții cutanate similare cu varicelă, prurit Rare: urticarie
Din corpul în reacțiile generale și locale foarte frecvent: durere și roșeață la locul de injectare este de multe ori: edem la locul injectării, febră (rectal t 38 C, axilă / cavitate bucală: t 37,5 ° C) Umflare la locul de injectare, și febră sunt foarte frecvente în studii efectuate la adolescenți și adulți. Edemul este, de asemenea, foarte frecvente, după a doua doză pentru copii de până la 13 ani. Tendința de creștere a cazurilor de durere și umflare la locul de injectare după administrarea celei de a doua doză a fost comparabil cu numărul de evenimente adverse observate după prima doză. Mai puțin frecvente: febră (t rectal 39,5 ° C; axila / cavitate bucală: t> 39 ° C), slăbiciune, stare generală de rău Nu au existat diferențe între profilul reactogenitate la indivizii inițial seropozitivi și seronegativi. Observând aplicarea masiva a cazurilor vaccin infecții cauzate cont Herpes Zoster, convulsii, ataxie, reacții de hipersensibilitate, reacții alergice (inclusiv reacții anafilactice și anafilactoide). Pacienții cu risc crescut Există doar date limitate din studiile clinice la pacienții cu risc ridicat curs de varicela complicate. vaccin reacție au fost fixate, în principiu, papule erupție veziculară și febră, care a avut un ușor curent.
Supradozaj Au fost înregistrate rapoarte individuale de supradozaj aleatoriu al vaccinului. Unii dintre ei au raportat despre apariția unor astfel de simptome, cum ar fi letargie, convulsii. În alte cazuri, supradozele nu au dus la apariția unor fenomene nedorite.
INTERACȚIUNEA CU ALTE MEDICAMENTE Vaccinarea cu medicamentul Varilrix® este posibilă nu mai devreme de trei luni după administrarea imunoglobulinelor sau după transfuzia de sânge. Trebuie evitat salicilați timp de 6 săptămâni după vaccinare Varilriks „, deoarece nu au fost raportate cazuri izolate de dezvoltarea sindromului Reye pe fondul unei infecții cauzate de un virus varicelo-zosterian natural.
Simultan cu numirea Varilriks® alte vaccinuri pot fi administrate concomitent cu vaccinuri inactivate Imunizare Programul Național al Federației Ruse și programul de imunizare privind indicii epidemice din Federația Rusă, cu excepția vaccinul anti-rabie. Varilrix® poate fi prescris în aceeași zi ca vaccinurile pentru a preveni rujeola, rubeola și oreionul. În acest caz, diferite vaccinuri sunt introduse în diferite părți ale corpului. Persoanele sănătoase - Varilrix "pot fi utilizate concomitent cu orice alte vaccinuri. Când se aplică cu vaccin rujeolic, în cazul în care vaccinările nu au fost efectuate în aceeași zi, se recomandă un interval de 30 de zile. Pacienții din grupurile cu risc crescut Varilrix * nu trebuie administrați concomitent cu alte vaccinuri vii atenuate, cu excepția vaccinului combinat cu rujeola, rubeola și oreion. Cu toate acestea, în cazul în care vaccinul nu a fost numit în același timp, intervalul dintre scopul lor de a atinge nivelul maxim de anticorpi ar trebui să fie de cel puțin 30 de zile.
Sa demonstrat că, la fel ca administrarea altor vaccinuri pentru prevenirea varicelei la persoanele vaccinate cazuri Varilriks „pot fi observate în continuare varicelei. Cu toate acestea, astfel de cazuri de varicelă apar de obicei sub formă ușoară, cu o cantitate mică de elemente vysypnyh și o tuse, în comparație cu cazurile de varicelă la indivizi nevaccinați. Sa demonstrat că în unele cazuri transmiterea tulpinii de vaccin a virusului poate apărea la persoanele seronegative de contact. Nu a existat nici o transmitere a virusului de la persoane vaccinate în absența leziunilor cutanate. pacienții vaccinați ale căror leziuni sunt detectate în decurs de 3 săptămâni de la vaccinare, ar trebui să evite orice contact cu femeile gravide (în special în timpul primului trimestru de sarcină), iar persoanele cu un sistem imunitar compromis, pentru o perioadă de 14 zile de la data apariției ultimelor erupții.
INFLUENȚA PRIVIND CAPACITATEA DE GESTIUNE A VEHICULULUI ȘI A MECANISMELOR DE TRANSMITERE Este puțin probabil.
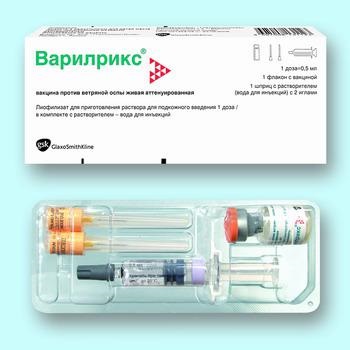
FORMULAR DE PROBLEMĂ Liofilizat: 0,5 ml (1 doză) într-o sticlă de sticlă limpede, incolorată, cu dop de cauciuc și capac de aluminiu pentru a se rupe cu o lamă detașabilă. Solvent: 0,5 ml pe fiolă de sticlă transparentă, incoloră. Pentru 0,5 ml într-o seringă din sticlă transparentă, incoloră, cu o capacitate de 1 ml, cu sau fără ac. Canulele acelor sunt închise cu un capac din cauciuc. O seringă fără ac este acoperită cu un capac din cauciuc. 1 flacon de vaccin și 1 fiolă cu un solvent în blister din polietilenă de înaltă densitate într-un carton pachet cu instrucțiuni de utilizare. 1 flacon cu un vaccin, 1 seringă cu solvent cu 1 sau 2 ace într-un blister din polietilenă de înaltă densitate într-un ambalaj de carton cu instrucțiuni de utilizare. 1 flacon cu un vaccin, o seringă fără ac cu un solvent într-un blister din polietilenă de înaltă densitate într-un ambalaj din carton cu instrucțiuni de utilizare. 100 sticle de vaccin pe pachet de carton cu 10 instrucțiuni de utilizare. Solvent pe 25 de fiole într-un blister din polietilenă, 4 blistere fiecare într-un pachet separat de carton.
Perioada de valabilitate a vaccinului liofilizat - 2 ani, solvent - 5 ani. Nu utilizați după data de expirare tipărită pe ambalaj. Data expirării este ultima zi a lunii indicate pe ambalaj.
CONDIȚII DE DEPOZITARE La o temperatură de 2 până la 8 ° C. Înghețarea nu este permisă. Solvent (pentru ambalaje de 100 de fiole) - la o temperatură de 2 până la 25 ° C. A nu se lăsa la îndemâna copiilor.
CONDIȚII DE TRANSPORT Transport la o temperatură de 2 până la 8 ° C. Înghețarea nu este permisă
Citiți de asemenea
Articole similare
Trimiteți-le prietenilor: