Interesul pentru vibrațiile chimice este determinat de speranța de a înțelege mecanismul proceselor biologice periodice.
Problema este: # xa0; faptul că pentru astăzi nu avem un model matematic satisfăcător pentru aceste oscilații, care au fost studiate experimental destul de bine.
Scopul acestei lucrări # xa0; - detaliu mecanismul reacției chimice omogen auto oscilant Belousov-Jabotinsky (B-F) în # xa0; cilindric de sticlă și # xa0; petri farfurie. Pentru a atinge acest scop, au fost studiate bazele teoretice ale reacțiilor chimice autociluitoare; S-au efectuat reacțiile lui G-G într-un pahar cilindric și un vas Petri; Se studiază mecanismul reacției auto-oscilante a lui G-Zh, se construiește o schemă a reacției auto-oscilante a lui G-G.
Versatilitatea dinamicii neliniare face important pentru o alegere bună a sistemelor de laborator, # xa0, care se poate studia formarea structurii (auto-organizare). Pentru a # xa0, astfel de sisteme de laborator includ auto oscilante reacție chimică omogenă, # xa0 deschis; B. # xa0; AP # xa0; Belousov și # xa0, mai târziu a studiat # xa0; A. # xa0; M. # xa0; Jabotinsky și # xa0; alți oameni de știință.
Belousov-Zhabotinsky reacție # xa0; - are loc în # xa0; auto oscilant modul de oxidare catalitică reducerea acidului bromic NVrO3. În acest caz, se observă fluctuații ale concentrațiilor de forme oxidate și oxidate reduse de catalizator și de anumite produse intermediare. Reacția are loc în # xa0; mediu acid (H2SO4), la # xa0; ionii utilizați drept catalizatori variabilă ceriu stare de oxidare Ce (SO4) 2: Ce3 + și # xa0; Ce4 +. În rolul agentului reducător este acidul citric ((HOOC) C (OH) (CH2COOH) 2).
Pentru realizarea experimentului s-au utilizat reactivi:
# xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; 160 mg de acid citric (HOOC) C (OH) (CH2COOH) 2 # xa0; - agent de reducere;
# xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; 3 mg de acid sulfuric (H2SO4) # xa0; - pentru crearea unui mediu acid;
# xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; 16g de bromat de potasiu (KBrO3) # xa0; - compus anorganic, o sare de potasiu, de metal alcalin și # xa0, acid bromic, cristale incolore, ușor solubil în # xa0; apă, este un oxidant puternic, poate fi utilizat în # xa0, ca praf de copt ( în unele țări, este interzisă) # xa0; - un aditiv alimentar E924; bromat de potasiu instabil termic, se descompune fără a se topi, formând o bromură și # xa0; oxigen. Acesta reacționează cu # xa0; acid sulfuric;
# xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; sulfat 3,5g ceriu (Ce (SO4) 2) # xa0; - pulbere albă, sare anhidră. Ion sulfat de ceriu [Ce (SO4) 24+] este un puternic agent de oxidare, în special în # xa0; mediu acid. sulfat de ceriu este utilizat drept catalizator.
Experimentul a avut loc după cum urmează: pe cântar electronic 16 g au fost contorizate # xa0; bromat de potasiu (KBrO3) și 3,5 g # xa0; ceriu sulfat (Ce (SO4) 2). Soluție preparată de acid sulfuric în H2SO4 # xa0; raport de 1/3 de apă distilată, soluție de acid citric: a # xa0; pahar de laborator se adaugă 60 g # xa0 acid citric a fost amestecat cu 100 ml de apă distilată. Apoi, în # xa0; balon au fost amestecate bromat de potasiu și # xa0; ceriu sulfat # xa0; acizi (Figura 1).

Fig. 1. Prepararea soluțiilor de acid citric (HOOC) C (OH) (CH2COOH) 2 (stânga) și # xa0; H2SO4 sulfuric (centru) de acid, amestecarea reactivilor cu # xa0; acizi (dreapta)
- # Xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; Explicarea reacției omogene de auto-oscilare a BL în paharul cilindric #
In experimentele # xa0; sticlă cilindrice fixe variație periodică a culorii de emisie spectrală a soluției din lăptoasă (concentrația maximă [Ce + 3]) la # xa0; portocaliu închis (concentrația maximă [Ce + 4]) și # xa0; spate cauzate de concentraţiile și vibrații oxidat # xa0, forma catalizatorului Ce (SO4) a redus 2 și # xa0; intermediari [Br-] (Figura 2):

Fig. 2. Etapele reacției Belousov-Zhabotinsky (valorile medii sunt date):
1 galben (lungime de undă, λ = 580 nm, frecvență, f = 520 THz, energie fotonică, E = 2,15 eV);
2 portocaliu deschis (lungime de undă, λ = 590 nm, frecvență, f = 510 THz, energie, Е = 2,10 eV);
- portocaliu (lungime de undă, λ = 620 nm, frecvență, f = 490 THz, energie fotonică, E = 1,98 eV);
- roșu (lungimea de undă, λ = 750 nm, frecvența, f = 410 THz, energia fotonică, E = 1,68 eV)
Tranziția de la pasul 1 la # xa0; Pasul 3 a fost însoțită de apariția bifurcații # xa0; - modificarea funcționării la starea de echilibru a sistemului # xa0; puncte individuale bifurcatii # xa0; - puncte în sistemul stării critice, la # xa0, care sistemul devine instabil cu privire la fluctuațiile și # xa0, există o incertitudine: este haotic sau dacă starea sistemului se va muta într-o nouă xa0, mai diferențiate și #, un nivel ridicat de ordine. În timp ce componentele de reacție nu a fost cheltuită se produce o astfel de tranziție. Stochasticity în # xa0; acest caz, este conținută în # xa0, probabilitatea de apariție a unor puncte de bifurcație.
Reacția chimică observată este o reacție exotermă, este însoțită de eliberarea de căldură, datorită ruperii legăturilor, produse de reacție de formare a legăturii, care afectează culoarea de emisie spectrală a soluției și # xa0, este energia fotonilor scade de la 2,15eV la 1,68 eV.
Perioada de oscilații T # xa0; în mod clar împărțit în două părți: T1 # xa0; - faza de oxidare a catalizatorului sau faza de creștere a concentrației [Ce4 +], etapele 1-3. și # xa0; T2 # xa0; - faza de recuperare a catalizatorului sau faza de scădere a concentrației [Ce4 +], etapa 4-2-1. a fost efectuat cu # xa0; folosind date experimentale. Menționăm că T # xa0; scăderea în timp: de la 1,5 la 0,6 minute (fig.3-4). După ce toate componentele reacției au fost consumate, reacția a încetat.
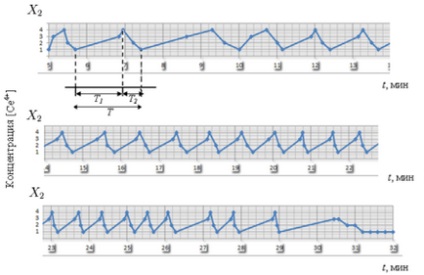
Fig. 3. Perioada de oscilație T # reacția lui Gd, care este împărțită în două părți: T1 # xa0; - faza de creștere [Ce4 +] și # xa0; T2 # xa0; - Faza de cădere [Ce4 +]
Diagrama obținută arată natura exponențială a modificării concentrației catalizatorului.
Regularitatea obținută satisface modelul Lotka # xa0; - Volterra, în care concentrația C # xa0; variază exponențial, și # xa0; concentrația [Br -] # xa0; - liniară:
unde: concentrația de autocatalizator [Ce3 +];
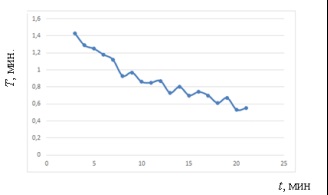
Fig. 4. Schimbarea perioadei T # xa0; pe tot parcursul experimentului
Programul pentru schimbarea perioadei T # xa0; arată regularitatea revelată # xa0; - reducerea inegală a perioadei de-a lungul întregului experiment.
Schematic vom descrie mecanismul unei reacții omogene de auto-oscilație B-G într-un pahar cilindric # (fig.5):
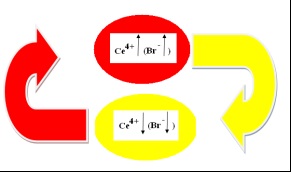
Fig. 5. Mecanismul de reacție a unei G-G omogene cu auto-oscilație
În prima etapă a reacției (oval roșu, T1) [Ce3 +] este oxidat de bromat. Concentrația [Ce4 +] crește:
Când se atinge pragul superior pentru concentrația de [Ce4 +], concentrația (inhibitorul) crește brusc, ceea ce duce la inhibarea reacției. [] interacționează cu particulele de reacție active și # xa0, dispare din sistem într-o oarecare măsură, ceea ce ajută la reducerea concentrației [Ce4 +].
Concentrația [Ce4 +] scade (oval galben), atinge o valoare de prag inferioară, în timp ce concentrația [] scade. Odată ce concentrația retarderului [] a scăzut, reacția începe cu # xa0; o rată ridicată: ceriul tetravalent este redus prin acid citric (HOOC) C (OH) (CH2COOH) 2:
După aceea, ciclul se repetă. Astfel, am identificat "orele" reacției: [].
Un dezavantaj al sistemului propus este că, în primul rând, aceasta nu conține # xa0, toate procesele chimice și # xa0; alocă doar două, și # xa0 majore, în al doilea rând, nu conține un model matematic de modele de oscilație.
Pentru a efectua experimentul în vasul Petri, s-a utilizat o soluție preparată în # xa0, experimentul anterior, care a fost plasat într-un strat subțire.
Se observă un proces autowave care rezultă din dispersia concentrației de catalizator pe neomogenitățile de suprafață.
Acest proces autowave este caracterizat prin dimensiuni temporale și spațiale, independent de condițiile inițiale și de dimensiunile geometrice ale sistemului.
Noi vedem, de asemenea o schimbare a emisiei spectrale de la galben la # xa0; portocaliu, cauzate de fluctuațiile în concentrațiile catalizatorului Ce (SO4) 2 și # xa0; intermediari de la galben la portocaliu (Figura 6). Modificarea concentrației [Ce + 3] și [Ce4 +] nu se produce sincronă în soluție, datorită fluctuațiilor în # xa0 oblic; puncte individuale soluție maxime apar inegal # xa0; diferite părți ale soluției.
Astfel, observăm valuri periodice de oxidare care provin de la o neomogenitate (un sit cu parametri modificați). Viteza de propagare a undelor de oxidare este constantă și este determinată de proprietățile spațiului și de perioada de succesiune # xa0 - parametrii din regiunea de heterogenitate # xa0;
Fig. 6. Schimbarea structurilor de la autowaves în reacția lui # xa0 cu M-G în # xa0; un vas Petri
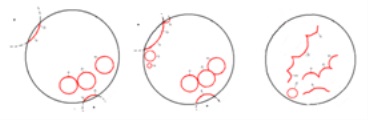
Fig. 7. Reprezentarea schematică a fronturilor în schimbare
În acest caz, există o sincronizare a mediului datorită unei creșteri locale a acidității sau a concentrației de bromat. Indicați A # xa0 și B # xa0; - creșterea acidității (A) și # xa0; creșterea concentrației de bromat (B); C # xa0 este punctul primei coliziuni a undelor de la A # xa0 și B; D # xa0; - captarea B # xa0 de către valurile emise de A; F # xa0 - dispariția completă a oscilațiilor în fază (figura 8).
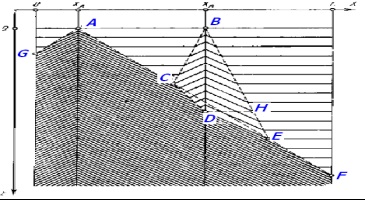
Fig. 8. Sincronizarea mediului: absorbția unui val cu altul
După concentrarea componentelor de reacție, și anume, concentrația "orelor" identificate ale reacției: [], a fost consumată, reacția încetează.
Astfel, în ciuda diferitelor condiții de experiment de curgere # xa0; pahar cilindric și # xa0; vas Petri: a # xa0; primul caz determina începutul procesului de auto-organizare sunt bifurcatii, al doilea # xa0; - dispersia concentrației catalizatorului pe neomogenitățile suprafață în # xa0; ambele cazuri detectate „ceas“ reacţii: [] # xa0; - ioni de brom, prezența valoarea dorită, care este principalul, dar nu singura condiție pentru lansarea de auto-organizare. De # xa0; tava de sistem „vânător-pradă“ aceste „ceas“ este alimentarea pentru victimă, în cazul în care alimentarea nu este suficient # xa0; - oi muri, și mor # xa0; lupi. În cazul în care alimentarea este foarte mult # xa0; - Lupi suprasaturat opri vânătoare în # xa0; ierarhia lor pachet va face schimb de legi ... T. # xa0; e. Universalitatea legilor autoorganizării este evidentă!
Termeni de bază (generați automat). Reacțiile paharului și un vas Petri, într-o cupă cilindrică și cup B-F, sulfat auto oscilante reacții B-F, ceriu, concentrația catalizatorului, componentele de reacție, o reacție chimică, acid citric, reacții în fază de catalizator de oxidare B-F într-o formă cilindrică, potasiu și sulfat de ceriu, mecanismul de reacție al unui auto oscilant, T1 - faza si T2 - faza, bromat de potasiu, faza de creștere, faza de scădere, o fază de creștere a concentrației, faza picătură de concentrare.
Trimiteți-le prietenilor: