Amintiți-vă de formularea primei legi a termodinamicii.
Are prima lege a termodinamicii un transfer spontan de căldură dintr-un corp mai puțin încălzit într-unul mai cald?
Sunt observate astfel de procese în natură?
Am observat deja că prima lege a termodinamicii este un caz special al legii conservării energiei.
Legea conservării energiei afirmă că cantitatea de energie din oricare dintre transformările sale rămâne neschimbată. Între timp, multe procese, complet permise din punctul de vedere al legii conservării energiei, nu au loc niciodată. De exemplu, în ceea ce privește prima lege a termodinamicii în sistem izolat posibil transfer de căldură dintr-o mai puțin încălzită către un corp mai încălzit, în cazul în care cantitatea de căldură produsă corp fierbinte, exact egală cu cantitatea de căldură dată corp rece. În același timp, experiența noastră sugerează că acest lucru este imposibil.
important
Prima lege a termodinamicii nu indică direcția proceselor.
A doua lege a termodinamicii. A doua lege a termodinamicii indică direcția transformărilor posibile de energie, adică direcția proceselor, exprimând astfel ireversibilitatea proceselor în natură. Această lege a fost stabilită prin generalizarea directă a faptelor experimentale.
Există mai multe formulări ale celei de-a doua legi, care, în ciuda diferenței externe, exprimă, în esență, același lucru și, prin urmare, sunt echivalente.
Omul de știință german R. Clausius (1822-1888) a formulat această lege în felul următor:
A doua lege a termodinamicii
Nu este posibilă transferul căldurii dintr-un sistem mai rece către unul mai fierbinte fără alte modificări simultane în ambele sisteme sau în corpurile înconjurătoare.
Aici este constatat faptul experimentat al unei anumite directivități a transferului de căldură: căldura însăși trece întotdeauna de la corpuri fierbinți la cele reci. Cu toate acestea, transferul de căldură se realizează dintr-un corp rece de depozitare la rece pentru o mai cald, dar această transmisie este asociată cu alte modificări ale organelor din jur: răcirea se realizează în detrimentul performanței.
Importanța acestei legi este că poate duce la o concluzie cu privire la ireversibilitatea nu numai a procesului de transfer de căldură, ci și a altor procese în natură.
Cum înțelegeți termenul "direcția procesului"?
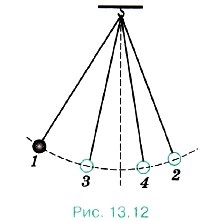
Să luăm în considerare un exemplu. oscilații pendulare din poziția scoși de echilibru sunt amortizată (Fig 13.12.) 1, 2, 3, 4 - pozițiile succesive ale pendulului la abaterile maxime de la poziția de echilibru). Datorită activității frecare forțează energia mecanică scade pendul și temperatura pendulului și aerul ambiental (și, prin urmare, energia lor internă) a crescut ușor.
Puteți să măriți din nou leagănul pendulului împingându-l cu mâna. Dar această creștere nu apare singură, ci devine posibil ca rezultat al unui proces mai complex, care implică mișcarea mâinii.
important
Energia mecanică trece în mod spontan în energia internă, dar nu invers. În acest caz, energia mișcării ordonate a corpului în ansamblul său este transformată în energia mișcării termice dezordonate a moleculelor sale constituente.
Ce procese ireversibile observi în viața de zi cu zi?
Un alt exemplu este procesul de difuzie. Deschizând flaconul cu parfum, simțim repede mirosul de parfum. Moleculele substanței aromatice pătrund în spațiul dintre moleculele de aer datorită mișcării termice. E greu de imaginat că toți se reunesc din nou într-un balon.
Numărul acestor exemple poate fi mărit aproape nedefinit. Toți spun că procesele în natură au o anumită direcție, care nu este reflectată în prima lege a termodinamicii.
important
Toate procesele macroscopice din natură au loc numai într-o direcție determinată.
În direcția opusă, ele nu pot să curgă spontan. Toate procesele din natură sunt ireversibile.
Anterior, în examinarea proceselor, am presupus că sunt reversibile.
Reține
proces reversibil - un proces care poate fi realizată atât în direcțiile înainte și înapoi prin aceleași stări intermediare, fără o schimbare în organele din jur.
Un proces reversibil trebuie să se desfășoare foarte lent, astfel încât fiecare stare intermediară să fie în echilibru.
Reține
O stare de echilibru este o stare în care temperatura și presiunea în toate punctele sistemului sunt aceleași.
Prin urmare, pentru ca sistemul să ajungă la o stare de echilibru, este nevoie de timp.
Este posibil să se descrie stările de neechilibru pe graficele dependenței macroparametrilor gazului?
Când studierea izoprotsessov am presupus că tranziția de la starea inițială la ultima trecere prin starea de echilibru, și numărate izotermă, izobară și procesul izocoră reversibil.
procese reversibile ideale în natură nu există, dar procesul real poate fi un anumit grad de precizie considerate ca fiind reversibile, ceea ce este foarte important pentru teoria.
Natura statistică a celei de-a doua legi a termodinamicii. A doua lege a termodinamicii determină direcția proceselor într-un sistem izolat, însă această lege are un caracter statistic (probabilistic).
Orice macrostat al unui sistem caracterizat prin unele macroparametere este determinat de microstatele sale. De exemplu, pentru un gaz, presiunea și temperatura sunt determinate de numărul de molecule, viteza lor, distribuția moleculelor peste volumul vasului. Dacă sistemul este lăsat la sine și este izolat, atunci, după cum știm, se atinge treptat o stare de echilibru, la care presiunea și temperatura la toate punctele sunt aceleași. Procesul de tranziție de la starea de non-echilibru într-un echilibru - un proces ireversibil.
Starea de echilibru corespunde mișcării haotice a moleculelor, adică sistemul, din punctul de vedere al microstațiilor, ajunge la haosul complet. Mișcarea haotică implică mișcarea continuă a moleculelor de gaz de-a lungul volumului, schimbarea vitezelor. Bineînțeles, dacă putem identifica molecule individuale, atunci ele se află la momente diferite în diferite părți ale vasului. Numărul moleculelor din volumul alocat poate fi, de asemenea, diferit etc. În același timp, macroparameterii gazului nu se modifică.
Mișcarea moleculelor este o mișcare mecanică care este reversibilă. În același timp, toate procesele ireversibile, cum ar fi transferul de căldură, se datorează mișcării mecanice a atomilor și moleculelor, deoarece coliziunile moleculelor asigură transferul de energie. Deci, procesele ireversibile sunt o consecință a mișcării mecanice reversibile.
Pentru a combina aceste două fapte incontestabile, Boltzmann a folosit conceptul de probabilitate. Astfel, starea gazului, în care moleculele se deplasează haotic, este cea mai probabilă și cea mai probabilă este distribuția uniformă a moleculelor peste volumul vasului.
Cu toate acestea, este posibil ca, datorită mișcării aleatorii a moleculelor, toate acestea să ajungă într-o parte a vasului, dar probabilitatea unei astfel de stări este extrem de mică.
Prin urmare, aceasta nu contrazice legile naturii, chiar și un astfel de proces, în care o mișcare aleatorie a moleculelor de aer, toate acestea se adună într-o jumătate din clasă, iar elevii din cealaltă jumătate a clasei se va sufoca. Dar acest eveniment nu sa întâmplat niciodată în trecut și nu se va întâmpla în viitor. Probabilitatea unui astfel de eveniment este prea mică pentru ca aceasta să se întâmple vreodată pe întreaga existență a universului în starea sa actuală - de câteva miliarde de ani.
Se estimează că această probabilitate este de aproximativ același ordin de mărime ca și probabilitatea ca cei 20 000 de maimuțe lovind aleatoriu chei pe o mașină de scris, imprimate fără greșeli, „Război și pace“ de Tolstoi LN. În principiu, acest lucru este posibil, dar nu se va întâmpla niciodată.
Limitele aplicabilității celei de-a doua lege a termodinamicii. Probabilitatea proceselor inverse de tranziție de la stări de echilibru la neechilibru pentru sistemele macroscopice ca un întreg este foarte mică. Dar pentru volume mici care conțin un număr mic de molecule, probabilitatea de abatere de la echilibru devine vizibilă.
Reține
Astfel de deviații aleatoare ale sistemului din echilibru se numesc fluctuații.
Prin fluctuațiile densității gazelor din regiunile de ordinul lungimii undei luminoase se explică împrăștierea luminii în atmosfera Pământului și culoarea albastră a cerului. Fluctuațiile presiunii în volume mici explică mișcarea Browniană.
Observarea fluctuațiilor servește ca o dovadă importantă a corectitudinii teoriei statistice a ireversibilității macroproceselor create de Boltzmann. A doua lege a termodinamicii este satisfăcută numai pentru sistemele cu un număr mare de particule. În volume mici, abaterile de la această lege devin deja esențiale.
Cuvinte cheie pentru a căuta informații despre subiectul paragrafului.
A doua lege a termodinamicii. Reversibilitatea proceselor
1. Ce procese se numesc ireversibile? Denumiți cele mai tipice procese ireversibile.
2. Cum este formulată a doua lege a termodinamicii?
3. Care stare a gazului este cea mai probabilă și corespunde stării de echilibru?
Articole similare
Trimiteți-le prietenilor: