Istoric istoric. In 1778 K. Scheele, încălzirea azotatul de grafit, am constatat că, în același timp ca și cărbunele este încălzit de nitrat, produce dioxid de carbon. Compoziția chimică a diamant a fost stabilit ca rezultat al experimentelor Lavoisier (1772), pentru a studia aerul de combustie și cercetarea diamant Tennant S. (1797), au demonstrat că aceeași cantitate de diamant și randamentul de cărbune în oxidarea unor cantități egale de dioxid de carbon. Carbonul a fost recunoscut ca element chimic în 1789 de către Lavoisier. Carbonul carbon "carbon" a fost derivat din carbohidrați. O Uniune 1961 Internațională de Chimie Pură și Aplicată (IUPAC) și fizică luate pe unitatea de greutate a izotopului de carbon al greutății atomice a 12C, abolire a existat înainte de oxigen scara de masa atomica. Masa atomică a carbonului în acest sistem este egal cu 12.011, așa cum este pentru o medie de trei izotop natural al carbonului în ceea ce privește prevalența lor în natură.
Carbonul este cunoscut din antichitate. Acesta a fost mult timp cunoscut faptul ca grafit pot fi marcate alte materiale, iar denumirea „grafit“, derivat din cuvântul grecesc care înseamnă „a scrie“ A.Vernerom propus în 1789. Cu toate acestea, istoria grafit confuz, de multe ori el a luat substanțe care au proprietăți fizice externe similare cum ar fi molibdonit (sulfura de molibden), la un moment dat a fost considerat grafit. Printre alte nume de grafit se cunosc "plumb negru", "fier carbid", "plumb argintiu". În 1779, K. Sheele a stabilit că grafitul poate fi oxidat prin aer cu formarea de dioxid de carbon.
Diamantele au fost folosite pentru prima dată în India și în Brazilia pietre achiziționate valoare comercială în 1725; depozitele în Africa de Sud au fost deschise în 1867. În secolul XX producătorii majori de diamante sunt Africa de Sud, Zair, Botswana, Namibia, Angola, Sierra Leone, Tanzania și Rusia. diamante artificiale, care a fost creat în 1970 tehnologie, fabricate în scopuri industriale.
Proprietăți fizice și chimice. Există patru modificări de carbon cristaline: grafit, diamant, carabină și londaide. Grafit - gri-negru, netransparent, uleios la atingere, solzos, masa foarte moale, cu luciu metalic, are o conductivitate. Atomii sunt aranjați în straturi paralele, formând o rețea hexagonală. În interiorul stratului, atomii sunt legați mai puternic decât un strat cu celălalt, astfel încât grafitul poate fi laminat. Arde la 700 ° C în prezența oxigenului. Apare în natură; se obține în mod artificial. La temperatură ridicată, presiune și risutstvii catalizator (mangan Mn, Cr crom, metale platină) grafit este transformat în diamant. Diamond este un mineral cu gălbui, alb, gri, verzui, mai puțin adesea albastru și negru. Nu conduce curent electric, conduce caldura slab. În cristal, atomii de carbon formează un cadru tridimensional continuu format din tetraedru articulat, care asigură o rezistență ridicată la legături. Diamond este cea mai grea substanță a tuturor celor cunoscuți. Punctul de topire este peste 3500 ° C. Din punct de vedere chimic stabil. Arde la 870 ° C în prezența oxigenului. La 1800 ° C, în absența oxigenului, se transformă în grafit. Cristale transparente; după prelucrare - diamante. Acestea sunt extrase din plăci și depozite indigene. Diamantul sintetic este obținut din grafit la presiune ridicată și temperatură. Este mai des translucid sau opac; are structura de cristal și proprietățile diamantului natural. carbon lichid poate fi preparat la presiuni de peste 10,5 MN / m (105 kg / cm²) și temperaturi de peste 3700єS. Cocs, negru de fum, cărbune (cărbune dur) au aceeași structură ca și carbonul solid grafit.Dlya asemenea stare caracteristică cu structura dezordonat - așa-numitul „amorf“ carbon. care nu este o modificare independentă; structura sa se bazează pe structura grafitului cu granulație fină. Încălzirea anumitor varietăți „amorf“ 1500-1600єS de carbon de mai sus, fără aer determină transformarea lor în grafit. Proprietățile fizice ale carbonului "amorf" depind foarte mult de dispersia particulelor și de prezența impurităților. Densitatea, capacitatea de căldură, conductivitatea termică și conductivitatea electrică a carbonului "amorf" sunt întotdeauna mai mari decât grafitul. Carbina este obținută artificial. Este o pulbere fină de culoare neagră (densitate = 2 g / cm3). Construită din lanțuri lungi de atomi de C, stivuite paralel unul cu celălalt. Lonsdaleite se găsește în meteoriți și se obține artificial; structura și proprietățile sale nu sunt stabilite definitiv.
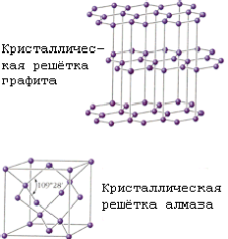
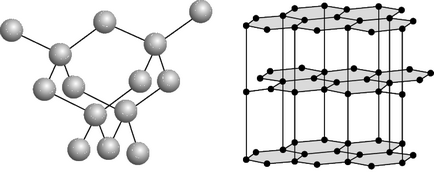
Structura diamantului (a) și a grafitului (b).
Configurația atomilor de carbon shell electron exterior 2sІ2pІ. Pentru patru carbon caracterizată prin formarea de legături covalente datorită excitării învelișului de electroni exterior la 2spі stare. Liantul chimică poate fi efectuată prin sp3 -, sp2 - și sp - orbitali hibride care corespund numerelor de coordonare 4, 3 și 2. Numărul de electroni de valență de carbon și numărul de orbitali de valență aceeași; Este unul dintre motivele de obligațiuni de stabilitate între atomii de carbon.
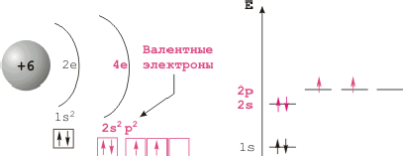
Structura atomului de carbon.
Capacitatea unică de atomi de carbon legați împreună pentru a forma un lanțuri și cicluri puternice și lungi au dus la apariția unui număr foarte mare de diferiți compuși de carbon (hidrocarburi) a studiat chimia organică.
În compuși, carbonul prezintă stări de oxidare de -4; 2; 4. Raza atomică 0,77B, raze covalente 0,77B, 0,67B, respectiv 0,60B în legături simple, duble și triple; raza ionică
C4-2,60B, C4 + 0,20B. În condiții normale, carbon este chimic inert, la temperaturi ridicate, se conecteaza cu multe elemente, care prezintă o puternică proprietăți reducătoare. Reactivitatea scade în ordinea: „amorf“ carbon, grafit, diamant; reacția cu oxigenul (ardere) are loc, respectiv, la temperaturi de peste 300-500єS, 600-700єS 850-1000єS și pentru a forma CO2 de dioxid de carbon și monoxid de carbon CO.
Izotopi de carbon. În natură, există șapte izotopi de carbon, dintre care trei joacă un rol esențial. Două dintre ele - și - sunt stabile, iar unul - - radioactiv (în corpul uman conține cu privire la aceasta 0,1mkkyuri). Cu utilizarea izotopilor de carbon în cercetarea biologică și medicală legate de mai multe progrese majore în studiul metabolismului și circulația carbonului în natură. Astfel, folosind marca radiocarbon sa dovedit a fi posibile plante de fixare N14SO3 și a țesuturilor de animale, este stabilit reacții de fotosinteză secventa studiat schimbul de aminoacizi, a trasat calea biosintetică a multor compuși biologic activi, și așa mai departe. D. Aplicarea 14C au contribuit la progrese in biologie moleculara pentru a studia mecanismele de biosinteza proteinelor și transferul informații ereditare. Determinarea activității specifice a 14C în reziduurile organice care conțin carbon oferă o indicație a vârstei, care este folosit în paleontologie și arheologie.
Carbon în corp. Carbon - cel mai important element biogene, care constituie baza vieții pe pământ, unitatea structurală a numărului mare de compuși organici implicați în construcția de organisme și metabolice lor oferind (biopolimeri, precum și numeroase molecule mici substante biologic active - vitamine, hormoni, mediatori etc.). O parte semnificativă a energiei necesare organismului este formată în celule datorită oxidării carbonului. Apariția vieții pe Pământ este considerată în știința modernă ca fiind un proces complex al evoluției compușilor carbonici.
Rolul carbonului în mediul sălbatic. Rolul unic al carbonului în natură, datorită proprietăților sale, care în total nu are nici un alt element al sistemului periodic. Între atomii de carbon și între carbon și alte elemente formează legături chimice puternice, dar care poate fi întreruptă în condiții fiziologice relativ blânde (aceste legături pot fi simple, duble sau triple). Capacitatea de a forma legături covalente echivalente cu 4 atomi de carbon, cu alți atomi de carbon creează posibilitatea de a construi orice tip de schelete de carbon - liniar, ramificat, ciclic. Este semnificativ faptul că toate cele trei elemente - carbon C, oxigen O, hidrogen H și - reprezintă 98% din masa totală a organismelor vii. Aceasta realizează o anumită economie în natură: în timp ce diversitatea structurală practic nelimitate de carbon compuși un număr mic de tipuri de legături chimice face reduce mult cantitatea de enzime necesare pentru digestia si sinteza substantelor organice. Caracteristici structurale ale atomilor de carbon formează baza de diferite tipuri de compuși organici izomerici (capacitatea a fost crucială în evoluția biochimice a aminoacizilor la izomeri optici, carbohidrați și anumiți alcaloizi de).
Conform ipotezei general acceptată Oparin, primul compus organic din lume a avut origine abiogenic. Sursele de carbon au fost metan (CH4) și acid cianhidric (HCN), conținut în atmosfera primară a Pământului. Odată cu apariția vieții numai sursa de carbon anorganic se formează datorită căreia tot materialul organic al biosferă este dioxidul de carbon (CO2), care este în atmosferă și dizolvat în apă naturală sub forma de HCO-3. Cel mai puternic mecanism de asimilare (asimilare) a carbonului (sub formă de CO2) - fotosinteză - (. Anuale asimilate aproximativ 100 miliarde de tone de CO2) transportate peste tot plantele verzi. Pe Pământ, există un mod mai vechi evoluționar de asimilare a CO2 prin chemosynthesis; în acest caz, nu microorganismele hemosintetiki utilizează energia solară radiantă, iar energia oxidarea compușilor anorganici. Majoritatea animalelor consuma produse alimentare cu conținut de carbon sub formă de compuși gata organici. În funcție de modul de asimilare a compușilor organici pentru a distinge autotrophs și heterotrophs. Aplicație pentru biosinteza proteinelor și a altor substanțe nutritive, microorganisme, folosind ca sursă unică de carbon, hidrocarburi din petrol, - una dintre cele mai importante probleme științifice și tehnice moderne.
Pe lângă funcția principală - sursa de carbon - CO2, dioxid de carbon dizolvat în apă naturală și fluidele biologice, este implicată în menținerea pH-ul optim pentru procesele vitale ale mediului. Compoziția de CaCO3 carbon formează un schelet exterior al multor nevertebrate (de exemplu, scoici coajă) și este conținut în corali, coji de ouă de păsări și altele asemenea. Acești compuși de carbon, cum ar fi HCN, CO, CCl4, predominante în perioada prebiological atmosfera pământului primar, numit în continuare , în procesul evoluției biologice, s-au transformat în antimetaboliți puternici ai metabolismului.
Ciclul carbonului. Carbonul este principalul element biogenic; joacă un rol important în formarea materiei vii în biosferă. Dioxidul de carbon din atmosferă prin fotosinteză, implementată de plante verzi, asimilat și transformat într-o varietate de plante și numeroși compuși organici. organisme din plante, microorganisme în special mai mici, fitoplancton marine, datorită reproducerii vitezei extraordinare produce anual aproximativ 1,5 · 10№№ tone de carbon sub formă de materie organică, care corespunde
5,86 · 10 J (1,4 · 10 є kcal) de energie. Plantele sunt consumate parțial de animale (aici se formează lanțuri alimentare mai mult sau mai puțin complexe). Materie In cele din urma organică din cauza respirației organismelor, descompunerea proceselor cadavrelor de fermentație putrefacție și combustia este transformată în dioxid de carbon sau depozitat în formă sapropel, humus și turbă, care la rândul lor dau naștere la multe alte caustobiolites -. Combustibilii fosili, ulei, gaze combustibile.
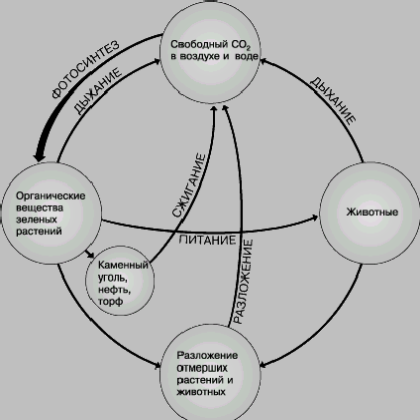
În procesele de descompunere a substanțelor organice, mineralizarea lor, un rol imens îl joacă bacteriile (de exemplu, putrefactive), precum și multe ciuperci (de exemplu, mucegaiuri).
În ciclul de carbon activ, o parte foarte mică din întreaga sa masă participă. O cantitate imensă de acid carbonic este conservată sub formă de calcar fosil și alte roci. Între dioxidul de carbon din atmosferă și apa de la ocean, la rândul său, există un echilibru mobil.
În t B g pe 1 cm² de pe suprafața Pământului
Animale 5 · 109 0.0015
Plante 5 · 10¹¹ 0,1
Atmosferă 6,4 · 10№№ 0,125
Articole similare
Trimiteți-le prietenilor: