Oxidul de calciu, atunci când se interacționează cu apa, se stinge, formând un hidroxid de calciu dăunător:
În acest caz, există o creștere semnificativă a volumului - de 2-3 ori. Procesul de hidratare a varului este accelerat de 1,5-2 ori când este stins cu o soluție slabă (1-5%) de NaCI, CaCl2 sau alți electroliți.
Rata de stingere a varului depinde de compoziția sa și de temperatura de ardere și poate varia de la câteva minute la mai multe ore. Tei puternic ars (la 1200 ° și mai sus) este hidratat încet87'88. Dispersia păsăricii este, de asemenea, redusă dacă este utilizată la producerea acesteia var, adorat la o temperatură prea mare.
În mod obișnuit, atunci când se răcește o vară activă, rapidă de stingere, este necesară îndepărtarea căldurii de reacție. Cu călire lentă, procesul trebuie efectuat fără disipare a căldurii pentru a evita încetinirea hidratării. Pentru a obține un loach fin dispersat, este necesară preîncălzirea apei folosite pentru călire.
Un aparat pentru stingerea varului este prezentat în Fig. 43581. Uneori, aparatul este livrat cu o haină pentru a menține temperatura necesară și pentru a usca stratul de var vărsat aderent pe pereții aparatului. Apa este furnizată în interiorul tamburului de plasă, încălzită la 85-95 °. Varul sa stins și sa sfărâmat într-o pulbere fină,
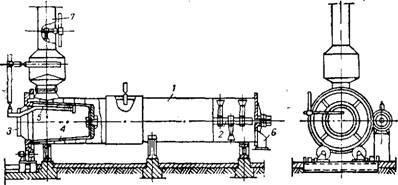
Fig. 435. Aparat pentru var cald:
1-tambur: 2-arbore cu lame; 3 - pâlnie de încărcare; 4 - tambur cu ochiuri;
5 pipe pentru alimentare cu apă; 5 - deschidere de descărcare; Conductă de iesire cu 7 conducte de apă
Când rola este rotită prin pereții săi; intră în tamburul exterior, se mișcă până la capăt cu lobi ai arborelui rotativ și este descărcat. Apa este dozată astfel încât puful la ieșirea din aparat să conțină umiditate de 0,5-2%. Stingerea cu o lipsă de apă are loc la o temperatură mai ridicată și duce la un proces mai complicat. Creșterea conținutului de umiditate din păsărică (mai mult de 2%) face dificilă transportul. Se propune accelerarea răcirii prin slăbirea lăcrimei prin suflarea aburului prin ea.
Pentru a elibera din piesele "nedopala" și "perepala" pu-shonku trec printr-o sită rotativă. Acest ecran este o rețea cu 64 găuri la 1 cm2 întinsă pe un cadru din lemn. Ea are forma unei piramide trunchiate octogon, situată orizontal și care se rotește în jurul axei sale. Păsărica cusută rămâne în buncăre nu mai puțin de 3 zile. Pe parcursul acestei perioade obturare este terminată complet retrasă Chiva-polidispersie a particulelor, a pushonkts de temperatură și umiditate redusă, dobândește o compoziție uniformă și poate, sub clorurare la graver.
După maturare în silozuri pushonka trebuie să conțină cel puțin 86% Ca (OH) 2, nu mai mult de 7% CaCO, 0.6-1% umiditate liberă și mai puțin de 6% impurități (Si02, R203, MgO etc.) la-absenta Corolarului oxid de calciu remarcabil. De obicei, aceasta conține 90-92% Ca (OH) 2, CaCC 2-4%, 0,5-0,9% umiditate și 5,5% din altă impuritate sey90. Densitatea sa
2,08 g / cm3, iar greutatea volumului variază între 0,4 și 1 g / cm3 (de obicei 0,55 până la 0,65).
Clorarea teoriei procesului Pushonka
Hidroxidul de calciu absolut uscat și clorul nu reacționează; clorul este adsorbit numai de var. În condiții de producție, un cedare care conține mai puțin de 1% umiditate liberă este supus clorării; Clorul utilizat în acest scop conține, de asemenea, o cantitate mică de umiditate. Chiar și un mic conținut de umiditate al materiilor prime asigură începutul reacției de hidroliză a clorului cu neutralizarea acizilor rezultați cu var. Apoi, hidroliza continuă în detrimentul apei, care este eliminată în timpul clorinării din hidroxid de calciu, iar toate cantitățile noi de var intră în proces; se formează un număr de compuși, din care se compune calcar (p. 1431).
In prima perioada puful de clorinare, aparent un amestec de hipoclorit de calciu dibazic și Obra-zuetsya SaS12 • Ca (OH) 2 • H20 conform reacției:
5Ca (OH) 2 + 2C12 = Ca (CO2), 2Ca (OH) 2 + CaCI2 · Ca (OH) 2 · H2O +
- Prin acest hidroxid Eliberat de calciu în faza lichidă și cheltuite în reacție cu clor: 2Ca (OH) z + 2S1g = Ca (C10) 2 + 2H20 + SaS12
Dar, din moment ce această reacție are loc într-o soluție saturată de știri, hipoclorit și clorură, de Ca nou format (C10) 2 și SaS12 alocate în fază solidă sub formă de fix-Leu SaS12 cu Ca (0H) 2-H20 și SAR (CYO) 2-2 Ca (OH) 2-2H20.
Trecerea unui hipoclorit de două baze într-un hipoclorit de două baze este însoțită de o scădere a cantității de fază lichidă, deoarece apa face parte din hidratul cristalin solid. În această etapă de clorinare se obține un produs foarte uscat și friabil.
Trimiteți-le prietenilor: