Structura sarcomului și contracția musculară
• Myosin II este un motor care asigură contracția musculară
• Actinul și miozina II sunt principalele componente ale sarcomerului, unitatea de bază de contracție a mușchilor striați
Muschii sunt un țesut capabil de contracție, care asigură mișcarea corpului și mobilitatea organelor. În funcție de aspectul fibrelor contractile, mușchii pot fi împărțiți în două grupe principale: striate și netede. Fibrele musculaturii striate sunt numite astfel încât, la mărirea mare, se poate vedea caracteristica lor. Acest grup include mușchii scheletici și cardiace.
Mușchii scheletici asigură mobilitatea scheletului și contracția cardiacă a inimii. Fibrele musculare netede nu sunt striate și au o formă de ax. Acești mușchi formează pereții organelor, de exemplu, vezica urinară, vasele sanguine și tractul gastro-intestinal.
Motorul proteic, care asigură contracția musculară, aparține familiei de myosin II. Această miozină aparține celor mai comune proteine vertebrate, este ușor izolată și, prin urmare, este una dintre proteinele bine studiate.
Figura de mai jos prezintă structura moleculei de myosin II, care constă din șase lanțuri polipeptidice: două lanțuri grele și două seturi, fiecare constând din două lanțuri ușoare.
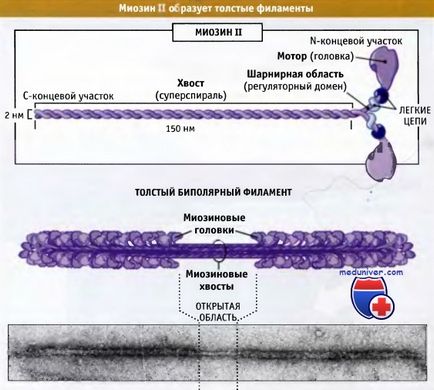
constând din două lanțuri grele și două perechi de lanțuri ușoare diferite.
Aceste complexe sunt asamblate în filamente bipolare groase.
Porțiunea distală a coastei miozinei II este asociată cu alte molecule de myosin II, formând fibre constând din aproximativ 300 de molecule de myosin. Aceste fibre sunt bipolare, iar domeniile motoare ale tuturor miozinelor sunt îndreptate departe de zona centrală. Aceste fibre se numesc filamente bipolare groase. În această secțiune, vom discuta despre organizarea și rolul miozinei II în contracția mușchilor striați. Aceste întrebări sunt bine studiate.
Mușchii striați constau din fascicule de fibre musculare. Acestea din urmă sunt celule multinucleare mari, lungimea cărora variază de la câțiva milimetri până la câțiva centimetri, iar diametrul este de 20-100 de microni. Figura de mai jos arată că fiecare fibră musculară este formată din mai mult de 1000 de miofibrili, care sunt organele în formă de tijă capabile de contracție. Myofibrilele constau în unități repetitive, numite sarcomere. Sarcomerele sunt situate una în spatele celeilalte și cauzează striacarea caracteristică a mușchilor.
Sarcomanele sunt principalele unități contractante ale mușchilor striați; cu contracția și relaxarea mușchiului, lungimea lor se schimbă. Așa cum se arată în figura de mai jos, sarcomerele conțin filamente groase constând în principal din filamente bipolare de myosin II și filamente fine care conțin filamente de actină și proteine reglatoare. Capetele filamentoase ale filamentelor actin pe o parte sunt atașate la structura sarcomerei, care este numită discul Z. În acest caz, toate filamentele actin dintr-o parte a discului Z au aceeași polaritate.
Actin filamentele se atașează la discul Z și sunt copiate prin legarea la proteina de copiere (CapZ), care împiedică depolimerizarea filamentelor de actină. Capetele ascuțite ale filamentelor actinice sunt orientate către centrul sarcomerului și sunt copiate de tropomodulină. Cu filamente actin, proteina de nebulină, de asemenea, interacționează; poate regla asamblarea fibrelor și lungimea filamentelor fine.
Filamentele groase sunt în centru, pe linia M, între discurile Z. Linia M este o structură constând din filamente bipolare grosiere conectate flexibil; aceste legături sunt fixate împreună de filamente groase, amplasate în interior hexagonal. Împreună cu linia M, proteina filamentoasă, denumită titan, formează legături elastice între discurile Z și filamentele de miozină. Titin furnizează centrifugarea filamentelor groase în sarcomer și acționează ca un arc care nu permite sarcomerului să se întindă.
Filamentele subțiri și groase se intersectează, formând o structură tridimensională de zăbrele. Deoarece sarcomerul este bipolar, în ambele jumătăți motoarele cu miozină față de actină sunt orientate în același mod. Cu reducere, domeniile motoare ale filamentelor cu miozin mixt interacționează cu filamentele fine de actină. Cu reducere, sarcomerul este scurtat prin alunecarea filamentelor subțiri și groase unul față de celălalt, ceea ce aduce discurile Z adiacente mai aproape de centrul sarcomerului. Pe măsură ce capetele miozinei se deplasează la capetele zimțate ale filamentelor actinice, lungimea filamentelor groase și subțiri rămâne posturală.
Lățimea sarcomerei în mușchiul vertebral relaxat este de aproximativ 3 μm, iar atunci când este contractată, devine aproximativ 2,4 μm.
În fibrele musculare, grupurile sunt scurtate. compuse din mii de sarcomere, ceea ce duce la scurtarea întregului mușchi. Lungimea totală a fibrei musculare scurte este determinată de doi factori: lungimea prin care fiecare sarcomer se scurtează și numărul sarcomerelor din grup. Valoarea procentuală pe care are loc scurtarea fibrelor musculare este aceeași, indiferent de lungimea lor.
Cantitatea de forță generată de sarcomer. este proporțională cu numărul de interacțiuni cu actomozină din jumătatea sarcomerului și cantitatea de forță pe care o dezvoltă fibrele musculare este proporțională cu numărul sarcomerelor paralele. Astfel, halterofilii își sporesc rezistența prin creșterea suprafeței secțiunii transversale a mușchilor și nu în detrimentul lungimii lor.
După cum se arată în figura de mai jos, contracția musculaturii striate este reglată cu participarea complexului troponin-tropomiozin, care este asociat cu actina în filamente fine. Moleculele de tropipiozină sunt polipeptide supracoate cu o lungime de 40 nm. Acesta este situat unul după altul de-a lungul spiralelor actinice. Troponina este un complex de trei proteine diferite: troponina C, troponina I și troponina T. Un complex se leagă de tropomiozină astfel încât să fie localizate de-a lungul filamentelor fine la intervale de 40 nm.
La concentrații scăzute de ioni de calciu, tropomyozina este într-o astfel de stare încât blochează situsul de legare a miozinei pe actină spațial, astfel încât relaxarea musculară și hidroliza ATP sub acțiunea miozinei are loc foarte încet. Datorită interacțiunii actinei cu miozina, sarcomerele relaxate sunt capabile de întindere pasivă, oferind o rezistență redusă.
Impulsurile nervoase determină eliberarea calciului în citosol din reticulul sarcoplasmic. Aceasta din urmă este o organelle care depozitează calciu în mușchi. O creștere a nivelului de calciu în citozol duce la legarea sa la troponină-C și la modificările conformaționale în molecula de proteină. Ca urmare a acestor schimbări, tropomyozina se îndepărtează de situsul de legare a miozinei în actină, iar miozina are posibilitatea de a interacționa cu actina și de a genera energie prin ciclul mecanochemic.
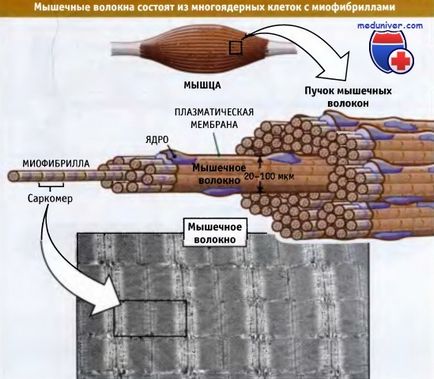
Myofibrilele sunt capabile de contracție și conțin unități structurale repetitive numite sarcomere.
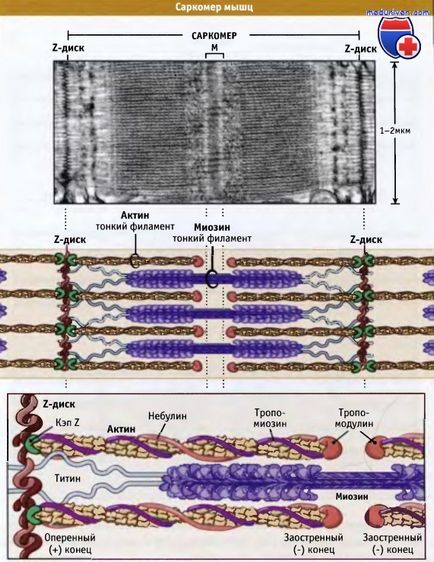
Filamentele de miozină hibride sunt conectate la discul Z prin proteina titinică și sunt interconectate între filamentele actinice.
Nebulinul trece de la discul Z la tropomodulină. Cu toate acestea, el nu știe cum se leagă actin.
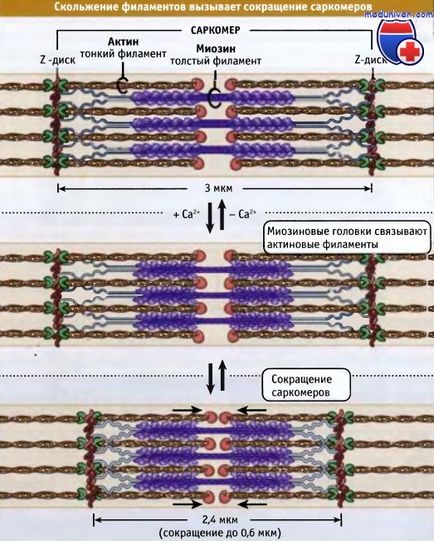
discurile Z se deplasează unul față de celălalt. Lungimea sarcomerelor scade.
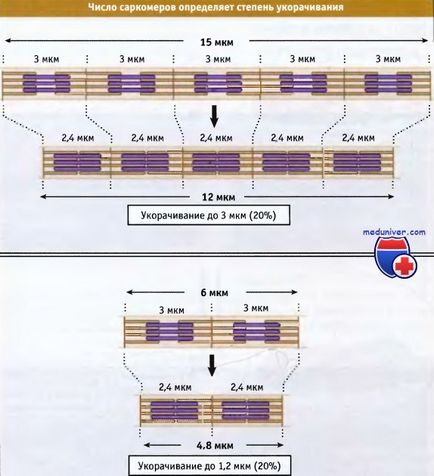
Cu toate acestea, procentul de scurtare nu depinde de numărul sarcomerelor.
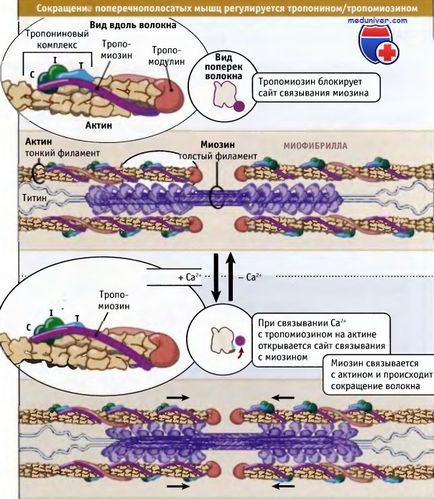
care determină poziția complexului de troponină / tropomiozină relativ la miozină și actină.
Trimiteți-le prietenilor: