
Acasă | Despre noi | feedback-ul
Un atom de clor, după cum se știe, are un efect inductiv negativ sau un efect mezomeric pozitiv, cu -I-efect -effect depășește + M. Astfel, acceptor de electroni este clor și împiedică fluxul de reacții de substituție electrofilă. Prin urmare, nitrarea clorobenzen apare la 7-8 ori mai lent decât nitrarea benzen. Cu toate acestea, viteza de reacție este suficient de mare, iar procesul este organizat într-un mod continuu, folosind o cascadă de trei sau patru reactoare. Inceput nitrare la 20-40 ° C (primul reactor), iar cele din urmă - la 70-80 ° C (ultimul reactor). Din ultimul reactor, masa de reacție intră în separatorul de fază, în care separarea de deșeuri acide (stratul inferior) din stratul organic (stratul superior). amestec Nitrochlorobenzene se spală succesiv cu apă, soluție de sodă și din nou cu apă, se usucă în vid și apoi direcționată spre separare, care se bazează pe diferența proprietăților chimice mononitrohlorbenzolov.
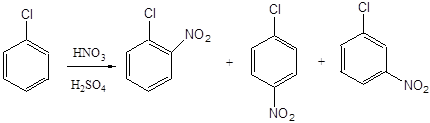
aproximativ 30% aproximativ 70% până la 1,5%
Importanța practică a trei nitrochlorobenzene izomeric sunt para- și orto-izomeri în care atomul de clor este într-o poziție activată și o grupare nitro poate fi ușor înlocuite cu diferite categorii, ca rezultat al reacțiilor nucleofile. Astfel, de la p-nitrochlorobenzene poate fi obținut p-nitrofenol, p-nitrofenetol, p-nitroanisol, p-nitroanilina, difenilamină și diverși derivați de difenil eter. Gruparea nitro din compușii de mai sus (cu excepția p-nitroanilină) poate fi redus ulterior la gruparea amino. Următoarele scheme pot fi propuse ca exemple:
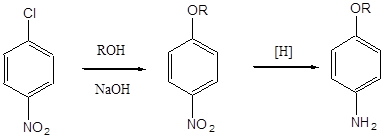
R = H p-nitrofenol p-aminofenol
R = OCH3 p-nitroanisol p-anisidină
R = OC2H5 p-nitrofenolol p-fenetidină
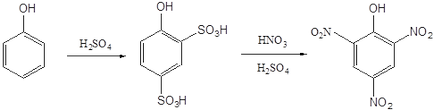
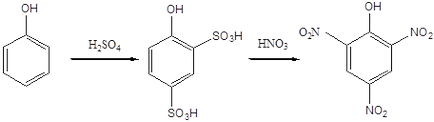
Atomul clorului din 2,4-dinitroclorbenzen poate fi, de asemenea, înlocuit cu ușurință de diverse grupuri ca urmare a reacțiilor nucleofile. În particular, prin acțiunea unei soluții apoase de hidroxid de sodiu sau amoniac, se obțin 2,4-dinitrofenol și 2,4-dinitroanilină. Conform uneia dintre tehnologiile din 2,4-dinitrofenol, acidul picric poate fi obținut prin nitrare.
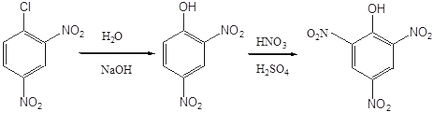
Acid picric. mp 122-122,5 о С. Explodează în timpul detonării în contact cu metalele și oxizii lor, se utilizează la producerea coloranților azo, explozivi explozivi, pentru a identifica diferiți compuși organici. Este un acid puternic, comparabil cu acizii minerali. Sucurile de acid picric sunt numite picrate. Sub formă de picrați, sunt izolați diferiți compuși organici instabili ai personajului principal.
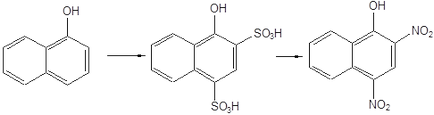
În mod similar, 1-naftol produce 1-hidroxi-2,4-dinitro-naftalină.
Gruparea amino este un substituent chiar mai puternic donator de electroni decât gruparea hidroxi. În același timp, gruparea amino în sine este ușor oxidată. Prin urmare, nitrarea directă a aminei aromatice nu este posibilă. În această privință, gruparea amino este pre-protejată. În mod tipic, pentru protejare este utilizată o grupare acetil sau tosil. În derivații N-acil- sau N-tosil ai aminei aromatice, bazicitatea grupării amino este redusă considerabil. Nitrarea acestor compuși are loc predominant în poziția para față de gruparea amino protejată. Gruparea protectoare din produsul nitro poate fi îndepărtată ulterior ca urmare a hidrolizei bazice sau a acidului. Ca exemplu, poate fi prevăzută o schemă de preparare a 2-metoxi-4-nitroanilinei.
Articole similare
-
Obținerea - clorbenzenului - o enciclopedie mare de petrol și gaze, articol, pagina 3
-
Tehnologia de producție a clorbenzenului - prezentare online
Trimiteți-le prietenilor: