Hidroliza sărurilor este un proces reversibil. Pentru el, ca și pentru orice altă reacție reversibilă, o stare de echilibru este caracteristică, care poate fi deplasată în conformitate cu principiul Le Chatelier. De exemplu, dacă acidiflați soluția de sare NH4CI, atunci echilibrul se schimbă spre stânga, adică hidroliza va încetini:
Când soluția este diluată, echilibrul se va deplasa spre dreapta, adică se intensifică hidroliza sarei.
Dacă sarea este formată slaba bază insolubilă (sau volatile) și un slab, volatile (sau insolubile) cu un acid, hidroliza unei astfel de sare se duce la capăt. De exemplu, soluția de Fe 2 (CO 3) 3 nu există, deoarece hidrolizează complet:
În rezultat, se precipită un precipitat maro de Fe (OH) 3 și se degajă gaz de CO2.
Motivul pentru hidroliza sărurilor peste cation este deplasarea echilibrului disocierii apei sub acțiunea cationilor de sare către acumularea de cationi de hidrogen.
Motivul pentru hidroliza sărurilor peste anion este deplasarea echilibrului disocierii apei sub acțiunea anionilor sării spre acumularea de anioni OH.
Motivul pentru hidroliza sărurilor prin cation și anion.
Deoarece sarea este formată dintr-o bază slabă și un acid slab, cationii și anionii sării descompun apă:
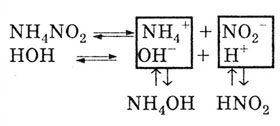
Ca rezultat, reacția mediului este fie neutră, fie slab acidă, fie slab alcalină. Aceasta depinde de gradul de disociere a acizilor slabi și a bazelor formate.
Sarcina. Scrieți ecuațiile reacțiilor de hidroliză:
- a) clorură de amoniu;
- b) acetat de sodiu într-o formă ionică moleculară și redusă.
Specificați reacția mediului. Cum se va schimba culoarea litmusului în soluțiile acestor săruri?
Soluție, a) Clorura de amoniu NH4CI - o sare formată din baza slabă a NH4OH și HCI acid tare, este hidrolizată de cation. Ecuația ionică redusă:
Pentru a scrie o ecuație moleculară, adăugați ioni care nu au participat la hidroliză, dar sunt în soluție. Acestea sunt ioni de clor:
Reacția mediului este acidă. Litmus devine roșie.
b) Acetat de sodiu CH3 COONa - sarea formată de baza tare de NaOH și acidul slab CH3COOH, este hidrolizată prin anion. Acest proces poate fi exprimat printr-o ecuație ionică redusă:
Adăugarea cationilor lipsiți de Na + dă ecuația moleculară:
Reacția este alcalină, litmusul este albastru.
Articole similare
-
Microphotografia - chimie pentru fotograf - secrete de fotografie
-
Cheat foaie - ceea ce face pechorin valoare cel mai mult în lume - literatura și limba rusă
-
Dombytkhim - producție, comerț cu ridicata cu produse chimice de uz casnic și produse cosmetice
Trimiteți-le prietenilor: