molecule de proteine sunt polimeri liniari compuse din reziduuri ale acizilor α-L-amino (care sunt monomerii) în compoziția de proteine pot include resturi de aminoacizi modificați și non-amino componente acide natura. Pentru a desemna aminoacizi în literatura științifică, se folosesc abrevieri de una sau trei litere. Deși la prima vedere ar putea părea că utilizarea majoritatea proteinelor „doar“ 20 de tipuri de aminoacizi limitează diversitatea structurilor de proteine, de fapt, numărul de opțiuni este dificil de estimat pentru lanțul de resturi de acid 5 aminoacizi, este deja mai mult de 3 milioane, și un lanț de resturi de 100 aminoacizi (proteine mici) pot fi reprezentate în mai mult de 10 130 de variante. Proteinele de la 2 până la câteva zeci de reziduuri de aminoacizi sunt deseori numite peptide. cu un grad mai mare de polimerizare - proteine. deși această diviziune este foarte arbitrară.
În formarea proteinei ca rezultat al interacțiunii grupării a-carboxil (-COOH) a unui aminoacid cu gruparea a-amino (-NH2) a unui alt aminoacid, se formează legături peptidice. Capetele proteinei sunt denumite capătul N- și C-terminal, în funcție de care din grupurile terminale de reziduuri de aminoacizi este liber: -NH2 sau, respectiv, -COOH. În sinteza proteinelor pe ribozom, primul rest de aminoacid (N-terminal) este de obicei reziduul de metionină, iar reziduurile ulterioare sunt adăugate la capătul C-terminal al celui precedent.
Nivelurile de organizare
Nivelurile organizării structurale a proteinelor: 1 - primar, 2 - secundar, 3 - terțiar, 4 - cuaternar
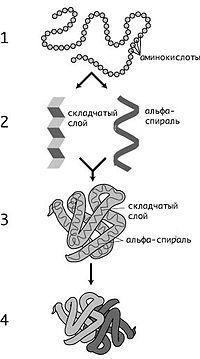
K. Lindström-Lang a propus să aloce 4 nivele de organizare structurală a proteinelor: structuri primare, secundare, terțiare și cuaternare. Deși această diviziune este oarecum depășită, ea continuă să fie utilizată [4]. Structura primară (secvența resturilor de aminoacizi) a polipeptidei este determinată de structura genei sale și a codului genetic, iar structurile de ordine superioare se formează în procesul de transformare a proteinei [19]. Deși structura spațială a proteinelor ca întreg este determinată de secvența lor de aminoacizi, este mai degrabă labilă și poate depinde de condițiile externe, deci este mai corect să vorbim despre conformația preferată sau cea mai favorabilă din punct de vedere energetic al proteinei [4].
Structura primară
Exemplu de aliniere a secvențelor de aminoacizi ale proteinelor (hemoglobine) de la diferite organisme
Structura primară este secvența resturilor de aminoacizi din lanțul polipeptidic. Structura primară a proteinei este în mod tipic descrisă folosind denumiri de o literă sau trei litere pentru resturile de aminoacizi.
Caracteristicile importante ale structurii primare sunt motivele conservatoare - combinații stabile de reziduuri de aminoacizi, care îndeplinesc o anumită funcție și apar în multe proteine. Motivele conservatoare sunt conservate în timpul evoluției speciilor, adesea prezicând funcția unei proteine necunoscute [20]. Prin gradul de omologie (similaritatea) secvențelor de aminoacizi ale proteinelor de diferite organisme, este posibil să se estimeze distanța evolutivă dintre taxele la care apar aceste organisme.
Structura proteinei primare poate fi determinată prin secvențierea proteinelor sau prin structura primară a ARNm-ului său, folosind tabelul cu cod genetic.
Articole similare
Trimiteți-le prietenilor: