Pentru lichidele solubile unele în altele în orice raport, legea lui Raoult este satisfăcută. Dacă presiunea de vapori saturată a solventului peste solventul pur este notată cu p0 și p este deasupra soluției, raportul (P0-P) / P0 va fi referit ca o scădere relativă a presiunii vaporilor peste soluție. Diferența (p 0 - p) = δp se numește scăderea absolută a presiunii vaporilor. Expresia matematică pentru legea lui Raoult este ecuația (P 0-P) / P 0 = X, unde X este fracția molară a substanței dizolvate.
Astfel, legea lui Raoult arată că scăderea relativă a presiunii unei vapori saturate dintr-un solvent pe o soluție este egală cu fracția molară a substanței dizolvate.
Dacă vorbim despre soluții de substanțe ne-volatile solide în solvenți volatili, presiunile parțiale ale substanțelor dizolvate sunt neglijate. Legea lui Raoult este valabilă pentru soluții de neelectroliți cu o concentrație foarte scăzută sau înaltă a uneia dintre componente. În concentrațiile intermediare, proprietățile soluțiilor deviază de la ideal, ceea ce indică prezența unei interacțiuni între solvent și substanța dizolvată.
Reducerea presiunii vaporilor saturați asupra soluției afectează punctul de fierbere și punctul de congelare al soluțiilor. Deoarece există o relație directă între fracția molară a substanței dizolvate și presiunea de vapori asupra soluției, este clar că efectul substanței dizolvate asupra temperaturilor de fierbere și congelare a soluțiilor este de asemenea legat de concentrația acesteia.
Investigând înghețarea și fierberea soluțiilor, Raul a stabilit următoarele modele:
1) o creștere a punctului de fierbere al soluției proporțional cu cantitatea de moli de substanță dizolvată, cu condiția ca numărul de moli ai solventului să fie constant:
unde E este constanta ebullioscopică, a cărei valoare are o valoare destul de clară pentru fiecare solvent și nu depinde de natura substanței dizolvate; Cl este concentrația molară a substanței. Sensul fizic al constantei ebullioscopice este că pentru Cl = 1 este egal cu creșterea punctului de fierbere al unei soluții monomolar, deoarece în acest caz δtk = E
2) o scădere a punctului de îngheț al soluției este proporțională cu numărul de moli ai substanței dizolvate cu o cantitate constantă de solvent:
unde K este constanta crioscopică, a cărei valoare nu depinde de natura substanței dizolvate, ci depinde numai de natura solventului.
Astfel, anumite proprietăți fizice ale soluțiilor diluate (presiunea vaporilor asupra soluției, punctul de fierbere și punctul de congelare) depind de concentrație și nu depind de natura substanțelor dizolvate în soluție. Prin urmare, aceste proprietăți sunt numite colligative (de la coliganul latin pentru colectare).
Când se studiază proprietățile soluțiilor, septa-membrane semipermeabile sunt utilizate pe scară largă, trăsătură caracteristică a cărora este capacitatea lor de a trece moleculele de solvent, dar pentru a reține particulele substanței dizolvate. (Figura 3).
Fenomenul transferului de masă al unui solvent printr-o membrană semipermeabilă, prin care moleculele mici pot penetra, dar care nu sunt capabile să treacă molecule mari dintr-o soluție diluată la o soluție cu o concentrație mai mare, se numește osmoză.
Presiunea care trebuie creată pe partea membranei unde soluția este localizată pentru a opri osmoza se numește presiune osmotică. Studiind fenomenul de osmoză permis van't Hoff deriva o ecuație care arată dependența presiunii osmotice (soluții non-electrolitice) concentrație: presiunea osmotică egală cu presiunea care a produs ar solute, dacă este sub forma gazului ideal ia aceeași cantitate la aceeași temperatură :
unde π este presiunea osmotică a soluției, Pa; Concentrația C în mol / l; R este constanta gazului universal; T este temperatura absolută.
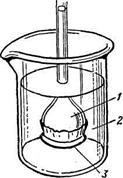

Figura 3. Dispozitiv pentru demonstrarea osmozelor: 1 - soluție; 2 - solvent; Membrană 3-semipermeabilă
Concentrația molară a soluției este determinată de formula
unde m este masa substanței dizolvate; M este masa molară a substanței; V este volumul soluției. Substituind această expresie în ecuația lui Van't Hoff, obținem
proprietăți coligative Descrise (punct de fierbere soluții de creștere a temperaturii, scădere a temperaturii de congelare, presiunea osmotică) sunt infinit soluții diluate de non-electroliti.
Introducere în soluția de electroliți (săruri, acizi și baze) va afecta, de asemenea, proprietățile coligative, dar în acest caz, există anumite particularități legate de natura electroliților înșiși. Astfel, dacă în apă pentru a dizolva 1 mol NaCl, molecula rezultată ionii dezintegrarea să apară în soluția de 2 mol de ioni (Na + 1 mol 1 mol și C1) și fiecare dintre acești ioni exercita efectul asupra soluției independente. Este de așteptat ca în NaCl apos (și molecule similare) proprietăți coligative vor apărea de două ori mai puternic decât, de exemplu, o soluție de zahăr în apă. Această ipoteză este confirmată experimental. Astfel, o scădere a punctului de congelare a unei soluții care conține 1 g de NaCI în 100 g de apă este aproape de două ori mai mare decât δt. calculată conform legii lui Raoult.
Efectul anormal al compușilor ionici asupra proprietăților colligative ale soluțiilor devine mai pronunțat la încărcarea ionică mare. Pentru ultima ecuație a fost aplicat pentru a determina presiunea osmotică a soluției, van't Hoff a introdus coeficient de corecție în acesta i (coeficientul izotonică), care indică în mod substanțial numărul efectiv de specii ionice sau moleculare formate dintr-un mol de substanță dizolvată. Prin urmare, ecuația ia forma P = 1000i (m / MV) RT
Multe procese biologice care apar în plantele și corpul animalelor sunt asociate cu osmoză datorită prezenței în ele a așa-numitelor membrane biologice. Membranele celulare sunt membrane care sunt permeabile la apă, nu trec substanțe dizolvate în fluidul intracelular. Mediul intern al celulei diferă de vâscozitatea externă, compoziția chimică, conținutul de ioni etc. Membrana exterioară limitează mediul intern din exterior și menține aceste diferențe pe tot parcursul vieții celulei. Schimbarea compoziției chimice a mediului înconjurător al celulei conduce la o schimbare a presiunii osmotice, care este asociată cu procese biologice importante cum ar fi turgorul. plasmoliză și hemoliză.
Nu are capacitatea de a suga sau pompa apa direct, celulele reglează fluxul de apă și fluxul de apă, schimbând concentrația de substanțe dizolvate în ele. Pentru a absorbi mai multă apă, celula absoarbe mai multe ioni de diferite săruri, molecule de glucoză sau alți compuși solubili. Ca urmare, concentrația de particule dizolvate în celulă crește. Apa sub legea osmozelor începe să intre în celulă, încercând să-și egalizeze propria concentrație pe ambele părți ale membranei.

Acest sistem funcționează atât timp cât concentrația substanțelor dizolvate în afara celulei și în celulă este aproximativ aceeași. Dacă concentrația medie de solut este mai mare decât celula în sine, sau dacă mediul de celule este în mod substanțial aer uscat, celula pierde apa, se micșorează așa cum se întâmplă atunci când plantele se ofilesc în zi fierbinte uscat. Odată cu scurgerea apei, conținutul contractului de celule și se îndepărtează de pereții celulelor (Figura 1).
Fig. 1. Turgor și vânătăi în plante.
A. Celulele din plante, înconjurate de soluție diluată, absorb apa prin osmoză prin membrana celulară și rămân turgide. B. Celulele din plante, înconjurate de o soluție concentrată, pierd apă din cauza osmozelor, iar planta devine umedă.
Dacă, totuși, planta aspirată este plasată în apă, apoi apa intră din nou în celule. Ei devin turgid; se umflă din apă și se presează din nou împotriva pereților celulari, ascultați presiunea turgorului, îndreptată din interior spre exterior. Pereții celulelor poate fi întins doar într-o anumită limită, după care începe să furnizeze contrapresiune, deplasarea apei din celule la aceeași rată cu care intră în ea. În acest fel, pereții celulelor protejează celulele: nu le permit să se spargă sub presiunea excesului de apă.
Multe celule de animale, dacă sunt plasate în apă pură sau într-o soluție foarte diluată, izbucnesc, deoarece nu au pereți celulari (Figura 2).
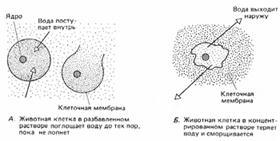
Fig. 2. Osmoză în celula animală.
Articole similare
-
Măsurarea unghiurilor orizontale și verticale pe teren - stadopedie
-
Probleme metodologice de diagnosticare a stărilor emoționale 441 - stadopedia
Trimiteți-le prietenilor: