Este de zece ori mai slab decât legăturile covalente. Acestea nu sunt anumite tipuri de legături, ci o interacțiune nespecifică care are loc între diferite grupuri chimice care au o mare afinitate unul cu celălalt (afinitatea este capacitatea de a interacționa). De exemplu: radicali încărcați opuși.
Astfel, tipurile slabe de conexiuni sunt interacțiuni fizico-chimice. Prin urmare, ele sunt foarte sensibile la schimbările în condițiile de mediu (temperatura, pH-ul mediului, puterea ionică a soluției etc.).
Conectarea hidrogenului este o legătură care apare între doi atomi electronegativi datorită unui atom de hidrogen, atașat covalent la unul dintre atomii electronegativi (vezi figura).
Legătura de hidrogen este de aproximativ 10 ori mai slabă decât legătura covalentă. Dacă legăturile de hidrogen se repetă de mai multe ori, atunci ele păstrează lanțurile polipeptidice cu rezistență ridicată. Legăturile de hidrogen sunt foarte sensibile la condițiile de mediu și la prezența unor substanțe care sunt capabile să formeze astfel de legături (de exemplu, uree).
CONECTARE IONICĂ - apare între grupuri încărcate pozitiv și negativ (grupări carboxil și amino suplimentare) care apar în radicalii de acizi lizină, arginină, histidină, aspartic și glutamic.
INTERACȚIUNEA HIDROFOBICĂ - atracția nespecifică care apare în molecula de proteine între radicalii aminoacizilor hidrofobi - este cauzată de forțele van der Waals și este completată de forța de flotabilitate a apei. Interacțiunea hidrofobă slăbește sau se rupe în prezența diferiților solvenți organici și a unor detergenți. De exemplu, unele consecințe ale acțiunii alcoolului etilic când pătrunde în organism se datorează faptului că, sub influența sa, interacțiunile hidrofobe în moleculele de proteine sunt slăbite.
Organizarea spațială a moleculei de proteine
Baza fiecărei proteine este un lanț polipeptidic. Nu este doar întins în spațiu, ci este structurat într-o structură tridimensională. Prin urmare, există un concept de 4 niveluri de organizare spațială a proteinelor, și anume, structurile primare, secundare, terțiare și cuaternare ale moleculelor de proteine.
Structura primară
Structura primară a proteinei este secvența fragmentelor de aminoacizi, ferm (și pe tot parcursul vieții proteinei) legată de legăturile peptidice. Există o perioadă de înjumătățire a moleculelor de proteine - pentru cele mai multe proteine de aproximativ 2 săptămâni. Dacă există o ruptură în cel puțin o legătură peptidică, se formează o altă proteină.
Structura secundară
Structura secundară este organizarea spațială a nucleului lanțului polipeptidic. Există 3 tipuri principale de structură secundară:
1) Alfa-helix - are anumite caracteristici: lățimea, distanța dintre două rotații ale spiralei. Proteinele sunt caracterizate de o spirală înfășurată la dreapta. În această spirală, există 36 de resturi de aminoacizi la 10 rotații. Toate peptidele puse într-o astfel de spirală, această spirală este absolut aceeași. O alfa helix este fixată prin intermediul legăturilor de hidrogen dintre grupările NH dintr-o singură rotație a bobinei și grupurile C = O ale bobinei vecine. Aceste legături de hidrogen sunt paralele cu axa helixului și se repetă de mai multe ori, astfel încât structura spirală este susținută ferm. Mai mult, este ținută într-o stare oarecum stresată (ca un prim comprimat).
B
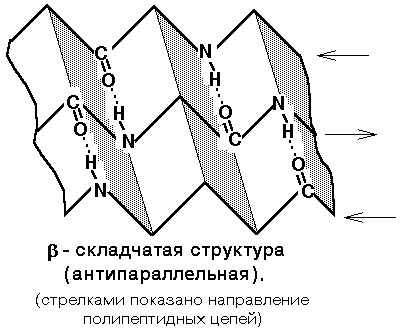
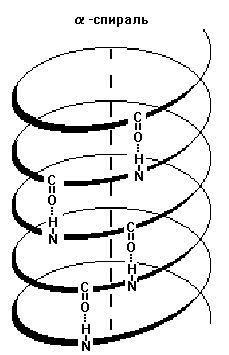
3) Structura neregulată - tipul structurii secundare în care localizarea diferitelor secțiuni ale lanțului polipeptidic relativ una față de cealaltă nu este regulată (permanentă), astfel încât structurile neregulate pot avea o conformație diferită.
Articole similare
Trimiteți-le prietenilor: