Trebuie remarcat faptul că radicalii polari pot interacționa cu moleculele de apă, deci ele sunt numite hidrofilice. Radicalii non-polari nu interacționează cu moleculele de apă, se numesc hidrofobe.
Există, de asemenea, o clasificare biologică a aminoacizilor, care ia în considerare posibilitatea sintezei lor în organism. Toți aminoacizii sunt împărțiți în interschimbabile (pot fi sintetizați în organism) și de neînlocuit sau esențiali (în organism nu sintetizează și trebuie să vină cu alimente). Unii aminoacizi bazici sunt capabili să fie modificați ulterior deja în compoziția moleculelor de proteine, ca urmare a reacțiilor chimice, cum ar fi hidroxilarea și metilarea. De exemplu, colagenul conține hidroxiprolină.
Se obișnuiește să se distingă patru niveluri ale organizării structurale a moleculei de proteine: structurile primare, secundare, terțiare și cuaternare. Să analizăm caracteristicile fiecăruia dintre aceste nivele.
Structura primară a proteinei este secvența de aminoacizi din lanțul polipeptidic. Structura primară a fiecărei proteine este unică și programată genetic.
Structura primară a proteinei este formată din legăturile peptidice formate în timpul interacțiunii # 945; carboxil cu un aminoacid cu Grupa amino a altui aminoacid. Lanțul polipeptidic constă în repetarea în mod regulat a regiunilor care formează o coloană vertebrală a catenei sau a unei peptide, și o parte variabilă cuprinzând catene laterale caracteristice, radicali de aminoacizi.
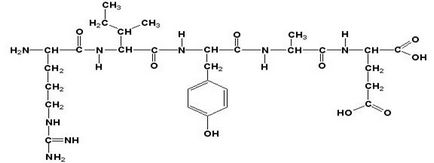
Unitățile de aminoacizi ale peptidei (proteina) sunt numite reziduuri de aminoacizi. Un reziduu de aminoacizi care conține liber # 945; - grupa amino, se numește N-terminal, iar reziduul are o valoare liberă # 945; -carboxil; -C-terminal. Formulele structurale ale peptidelor sunt înregistrate și citite de la capătul N-terminal. Toate resturile de aminoacizi care alcătuiesc polipeptida (cu excepția C-terminalului) obțin în final -il în loc de -in. Numele acestei peptide este argilizoleucil-tirosil-glutamat.
Structura primară a proteinei, adică setul și secvența de aminoacizi determină proprietățile sale fizico-chimice și biologice ulterioare.
Explicarea secvenței de aminoacizi a proteinelor este de interes din mai multe motive.
În primul rând, schimbarea secvenței aminoacizilor ca urmare a mutației poate duce la o întrerupere a funcției normale a proteinei și, în consecință, la dezvoltarea bolii. O astfel de boală gravă ca anemia celulă seceră rezultă din înlocuirea unui singur aminoacid într-o singură proteină.
În al doilea rând, cunoașterea secvenței de aminoacizi este importantă pentru elucidarea bazei moleculare a activității biologice a proteinei.
În al treilea rând, un studiu comparativ al secvențelor de aminoacizi din proteine face posibilă urmărirea evoluției la nivel molecular.
În al patrulea rând, este necesar să se clarifice principiile pe baza cărora se formează structuri spațiale foarte specifice din lanțurile de polipeptide. S-a stabilit că secvența resturilor de aminoacizi ale lanțului polipeptidic proteic poartă informațiile necesare pentru formarea structurii spațiale a moleculei de proteină. Procesul de pliere a unui lanț polipeptidic în structura tridimensională corectă se numește pliere.
Până de curând, sa crezut că formarea structurii spațiale a proteinei are loc în mod spontan, în absența oricăror componente. Cu toate acestea, sa descoperit recent că acest lucru este valabil doar pentru proteine relativ mici (aproximativ 100 de resturi de aminoacizi). Pentru plierea proteinelor mari sunt necesare proteine speciale, care permit formarea rapidă a structurii spațiale corecte a proteinei.
Structura secundară a proteinei este o metodă de pliere a unui lanț polipeptidic într-o spirală sau altă conformație. Sunt formate legături de hidrogen între grupările CO și NH ale catenei peptidice a unui lanț sau lanțurile polipeptidelor adiacente. Sunt cunoscute mai multe tipuri de structuri secundare ale lanțurilor peptidice, dintre care principalele sunt # 945; - helix și # 946; -fold layer.
# 945; - spirala este o structură rigidă, arată ca o tijă. Partea interioară a acestei tije creează un schelet al peptidei bine răsucite, radicalii aminoacizilor direcționați spre exterior. În acest caz, gruparea CO a fiecărui rest de aminoacid interacționează cu gruparea NH a celui de-al patrulea reziduu. La o rotație a helixului, există 3,6 reziduuri de aminoacizi, iar pasul spiral este de 0,54 nm. Unii aminoacizi împiedică coagularea lanțului în # 945; - helix, iar în locul locației lor, continuitatea spirală este întreruptă. Acești aminoacizi includ prolină (în care atomul de azot face parte dintr-o structură inelară rigidă și rotația în jurul legăturii N-Ca devine imposibilă). precum și aminoacizii cu radicali încărcați sau volumetric care interferează electrostatic sau mecanic cu formarea lui # 945; - spirala.
# 914; - Stratul pliabil diferă de # 945; - căștile prin faptul că are o formă plană, mai degrabă decât o formă de tija. Se formează prin legături de hidrogen în cadrul uneia sau mai multor lanțuri de polipeptide. Lanțurile peptidice pot fi amplasate într-o direcție (paralelă) sau în direcții opuse (antiparalel). asemănătoare blănurilor de acordeon. Radicalii laterali sunt localizați deasupra și dedesubtul planului stratului.
Structura terțiară a unei proteine este distribuția în spațiu a tuturor atomilor unei molecule de proteină, sau cu alte cuvinte, împachetarea spațială a unui lanț polipeptidic spiralat. Principalul rol în formarea structurii terțiare a proteinei este jucat de legăturile hidrogen, ionice, hidrofobe și disulfidice, care se formează ca rezultat al interacțiunii dintre radicalii de aminoacizi.
Legăturile de hidrogen se formează între doi radicali polari, dintre care unul poate avea o încărcătură.
Legăturile ionice pot apărea între radicali încărcați opuși.
Interacțiunile hidrofobe sunt caracteristice radicalilor nepolari.
Legăturile disulfurice se formează între grupările SH de doi radicali cisteinici localizați în diferite părți ale lanțului polipeptidic.
Conform formei moleculei și a caracteristicilor formării structurii terțiare, proteinele sunt împărțite în fibrilare și globulare.
Proteinele fibrilare - au o formă filiformă (fibrile), formează fibre și fascicule de fibre. Între lanțurile polipeptidelor adiacente, există multe legături încrucișate transversale covalente. Insolubil în apă. Tranziția la soluție este împiedicată de radicalii nonpolari de aminoacizi și de legăturile între lanțurile peptidice. În organism, efectuați în principal o funcție structurală, asigurați rezistența mecanică a țesuturilor.
Exemple de proteine fibrilare:
Colagenul este o proteină a țesutului conjunctiv. În compoziția sa predomină aminoacizii glicină, prolină, hidroxiprolină.
Elastina este mai elastică decât colagenul, face parte din pereții arterelor, țesutul pulmonar, componentele sale sunt aminoacizii glicina, alanina, valina.
Keratina este o proteină a epidermei și a derivaților de piele, în structura sa prevalează cisteina aminoacidului.
Proteinele globulare - au o formă sferică sau elipsoidală a moleculei (globule). În procesul de formare a globulelor, radicalii hidrofobi ai aminoacizilor sunt imersați în regiuni interne, radicalii hidrofilici sunt localizați pe suprafața moleculei. Când interacționează cu faza apoasă, radicalii polari formează numeroase legături de hidrogen. Proteinele sunt reținute în stare dizolvată din cauza încărcăturii și a carcasei hidratate. În organism, proteinele globulare îndeplinesc funcții dinamice (transport, enzimatic, de reglementare, de protecție).
Exemple de proteine globulare:
Albuminul este o proteină a plasmei sanguine; conține multe reziduuri de glutamat și aspartat; precipitat la 100% saturație a soluției cu sulfat de amoniu.
Globulinele sunt proteine ale plasmei sanguine; în comparație cu albumina au o greutate moleculară mai mare și conțin mai puține reziduuri de glutamat și aspartat, se precipită cu o saturație de 50% a soluției cu sulfat de amoniu.
Histones - fac parte din nucleele celulelor, unde formează un complex cu ADN. Conține multe reziduuri de arginină și lizină.
Globulele globulare ale unui număr de proteine, cum ar fi imunoglobulinele, constau din mai multe fragmente independente, pliate compact ale lanțului polipeptidic, care sunt numite domenii. Proteinele de domeniu sunt, ca atare, o formă de tranziție la nivelul următor al organizării structurale a proteinelor.
Structura cuaternară a proteinei - plasarea în spațiu a subunităților interacționate formate din lanțurile polipeptidice individuale ale proteinei. Structura cuaternară - cel mai înalt nivel de organizare a moleculei de proteine, și opțional - mai mult de jumătate din proteinele cunoscute nu. Proteinele care au o structură cuaternară sunt, de asemenea, numite oligomeri, iar lanțurile polipeptidice incluse în compoziția lor sunt subunități sau protomeri. Protomerii pot fi identici sau diferiți în structura lor primară.
Fiecare dintre protomeri este sintetizat ca un lanț polipeptidic separat care se îndoaie într-un globule și apoi se combină cu alți protomeri. Sindicatul merge prin auto-asamblare. Fiecare dintre protomeri conține site-uri care sunt complementare altor protomeri. Interacțiunea dintre regiunile de contact ale protomerilor are loc cu ajutorul legăturilor hidrofobe, ionice și hidrogen.
Exemple de proteine oligomerice pot servi drept hemoglobină de proteine eritrocitare, enzima lactat dehidrogenază și multe altele. Aceste proteine pot exista sub formă de câteva conformații stabile. Proteinele care posedă o structură cuaternară sunt caracterizate de proprietăți alosterice, adică sunt capabile să treacă de la o conformație la alta cu o schimbare a activității lor funcționale.
Mai detaliat, organizarea structurală și funcționarea proteinelor oligomerice vor fi luate în considerare în viitor folosind exemplul de hemoglobină.
Unele proteine sunt cunoscute, molecula lor constând din două sau mai multe lanțuri de polipeptide legate prin legături disulfidice (de exemplu, insulina hormonală). Astfel de proteine nu pot fi considerate oligomere. Aceste proteine sunt formate dintr-o catenă polipeptidă unică ca urmare a hidrolizei parțiale - scindarea locală a legăturilor peptidice. Proprietățile alosterice caracteristice proteinelor oligomere, nu protejează aceste proteine.
Navigare după înregistrări
Articole similare
-
Infecții și boli parazitare, lucrări gratuite de curs, rezumate și teze
-
Clasele de severitate a pacienților cu infarct miocardic, lucrări gratuite de curs, rezumate și teze
-
Metoda de selecție a rulmenților de rulare, curs liber, rezumate și teze
Trimiteți-le prietenilor: