Patologia metabolismului proteinelor
Proteinele sunt polimeri neramificați, a căror structură minimă este aminoacidul (AA).
Aminoacizii sunt legați împreună printr-o legătură peptidică. Compoziția proteinelor include 20 AA în forma alfa, localizată într-o secvență diferită, dar strict definită pentru fiecare secvență de proteine.
Proteinele organismului includ aproximativ 16% azot, care în unele metode este un marker al unei substanțe de origine proteică.
Informațiile privind numărul total de proteine plasmatice (proteine totale din sânge) se obțin, de obicei, prin metode refractometrice și biuret fotometrice.
Plasma de sânge uman conține în mod normal mai mult de 100 de tipuri de proteine.
Aproximativ 20% din proteina totală sunt albumine, imunoglobuline, lipoproteine, fibrinogen, transferină etc.
Valorile normale ale proteinei totale din plasmă: 65-85 g / l.
I. Despre structura chimică
Alifatic - glicina (Gly), alanina (Ala), valina (Val), leucina (Leu), izoleucina (Ilei);
§ Oxigenați - serină (Ser), treanină (Tre);
§ Dicarboxilic - asparagină (Asp), glutamină (Glu), acid aspartic (Asc), acid glutamic (Glk);
§ Dibazic-lizină (Liz), histidină (Gis), arginină (Arg);
§ Aromatic - fenilanină (Phen), tirozină (Tyr), triptofan (trei);
§ Sulf - conținând - cisteină (cis), metionină (Meth).
II. Prin rolul biochimic:
§ glucogenice - printr-o serie de transformări chimice pentru a ajunge cale glicolitice (oxidarea glucozei) - Gly, Ala, Thr, Val, ASK, GLA, Arg, Giese, Meth.
§ ketogenic - participă la formarea corpurilor cetone - Lei, Ilei, Tyre, Fen.
§ Nelimitat - nu sintetizat în corp - Gis, Ile, Lei, Liz, Met, Fen, Tre, Trei, Val.
Datorită prezenței în moleculă a grupărilor AA simultan cu amine și carboxil, acești compuși au proprietăți bazice pe bază de acid. Într-un mediu neutru, AK există sub formă de ioni bipolari-zwitter, adică nu NH2-COOH. și NH3 + -R-COO-.
Dacă gruparea carboxil a unei AA acilizează gruparea amino a altui AK, se formează o legătură amidică covalentă, care se numește o legătură peptidică. astfel peptidele sunt compuși formați din resturile de alfa-AA, legați împreună printr-o legătură peptidică.
Această relație este relativ stabilă, iar perturbarea acesteia are loc numai cu participarea enzimelor specifice catalizatorilor. Prin această conexiune AK-urile sunt combinate în lanțuri suficient de lungi, numite polipeptide. Fiecare astfel de lanț conține la un capăt AA o grupare amino liberă - acesta este un rest N-terminal și, pe de altă parte, cu o grupare carboxil - un rest C-terminal.
Polipeptidele capabile să formeze și să rețină spontan o structură spațială specifică, numită conformație, sunt denumite proteine.
Stabilizarea unei astfel de structuri este posibilă numai atunci când polipeptidele ating o anumită lungime, prin urmare, polipeptidele cu o greutate moleculară mai mare de 5000 Da sunt de obicei considerate proteine. (1 Da este egal cu 1/12 din izotopul de carbon). Doar având o anumită structură spațială, proteina poate funcționa.
1. Proteinele structurale (plastice) sunt formate din multe componente celulare, iar în combinație cu lipide fac parte din membranele celulare.
2. Catalizatori - toți catalizatorii biologici - enzimele sunt chimice în natură, sunt proteine.
3. Transport - hemoglobina de proteine transportă oxigen, un număr de alte proteine care formează un complex cu lipide le transportă prin sânge și limf (de exemplu, myoglobina, albumină serică).
4. Mecanochimic - munca musculară și alte forme de mișcare în organism sunt efectuate cu participarea directă a proteinelor contractile folosind energia legăturilor macroergice (de exemplu, actina, miozina).
5. Regulament - un număr de hormoni și alte substanțe biologic active sunt de natură proteică (de exemplu, insulină, ACTH).
6. Anticorpii de protecție (imunoglobulinele) sunt proteine, în plus, baza pielii este colagenul proteic, iar părul - cheratina. Pielea și părul protejează mediul interior al organismului de influențele externe. Compoziția mucusului și a fluidului sinovial include mucoproteinele.
7. Suportul - tendoanele, suprafețele articulațiilor oaselor se formează în mare parte prin substanțe proteice (de exemplu, colagen, elastină).
8. Energie - aminoacizii proteinelor pot intra în calea glicolizei, care furnizează energiei celulei.
9. Receptor - multe proteine participă la procesele de recunoaștere selectivă (receptori).
Nivelurile de organizare a moleculei de proteine
În literatura modernă, este obișnuit să se ia în considerare 4 niveluri de organizare a structurii unei molecule de proteine.
Secvența resturilor de aminoacizi conectate printr-o legătură peptidică se numește nivelul primar de organizare a moleculei de proteină. Acesta este codificat de gena structurală a fiecărei proteine. Legături: punți de peptidă și disulfură între resturile cisteinei relativ îndeaproape. Acestea sunt interacțiuni covalente care sunt distruse numai sub acțiunea enzimelor proteolitice (pepsină, tripsină, etc.).
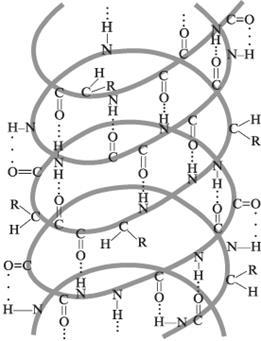
Structura secundară este dispunerea spațială a atomilor din lanțul principal al moleculei de proteină. Există trei tipuri de structură secundară: helix alfa, pliere beta și îndoire beta. Se formează și se reține în spațiu datorită formării legăturilor de hidrogen între grupurile laterale ale lanțului principal AK. Legăturile de hidrogen se formează între atomii de oxigen electronegativi ai grupărilor carbonil și atomii de hidrogen ai doi aminoacizi.
Alfa-helix este un tirbuș de lanț peptidic răsucite în jurul unui cilindru imaginar. Diametrul unei astfel de spirale este de 0,5 A. În proteinele naturale, se găsește doar spirala potrivită. Unele proteine (insulină) au două spirale paralele. Beta pliabilă - lanțul polipeptidic este asamblat în pliuri echivalente. Beta-îndoire - este format între trei aminoacizi datorită legăturii de hidrogen. Este necesar să se modifice aranjamentul spațial al lanțului polipeptidic atunci când se formează structura terțiară a proteinei.
O structură terțiară este o modalitate de a stabili o polipeptidă a unui lanț în spațiul caracteristic unei proteine date. Aceasta este baza funcționalității proteinei. Acesta asigură stabilitatea ariilor mari de proteine, constând din multe reziduuri de aminoacizi și grupuri laterale. Astfel de regiuni de proteine dispuse în spațiu formează situsuri active de enzime sau zone de legare. Deteriorarea structurii terțiare duce la pierderea activității proteice funcționale.
Stabilitatea structurii terțiare depinde în principal de interacțiuni necovalente în Globula proteină - în principal legături de hidrogen, forțe van der Waals (ionice sau electrostatice) și interacțiuni hidrofobe. Cu toate acestea, unele proteine sunt stabilizate în continuare prin interacțiuni covalente, cum ar fi punți disulfidice Mezhuyev resturile de cisteină.
Cele mai multe molecule de proteine au site-uri de helix alfa și de pliere beta. Dar mai des, sub forma unei structuri terțiare, proteinele globulare sunt separate - construite predominant din alfa-helices și având forma unei mingi sau a unei elipse (majoritatea enzimelor). Și fibrilă - constând, în esență, din pliere beta și având o formă aplatizată sau filiformă (pepsină, proteine de cai de legătură și cartilaj).
Plasarea în spațiu a subunităților interacționate formate din lanțurile polipeptidice individuale se numește o structură cuaternară. Ie în formarea structurii cuaternare, nu în sine lanțurile peptidice, ci globulele formate separat de fiecare dintre aceste lanțuri. Structura cuaternară este cel mai înalt nivel de organizare a moleculei de proteine și nu este inerentă în toate proteinele. Legăturile care formează această structură sunt necovalente: hidrogen, electrostatic.
Principiul fundamental al biologiei moleculare. secvența resturilor de aminoacizi ale catenei de polipeptidă proteică poartă toate informațiile necesare pentru a forma o structură spațială specifică. Ie disponibil în secvența de aminoacizi a proteinei determină formarea alfa sau conformație beta a structurii secundare datorită formării dintre aceste legături de hidrogen sau disulfidice AK și formarea în continuare o structură globulară sau fibrilyarnoy ca prin vzaiomdeystvy necovalente între parcelele laterale este anumiți aminoacizi.
II. Conform structurii conformationale:
§ fibrilare (colagene, elastine, keratină);
§ globule: albumine, globule, histone (toate enzimele și majoritatea BAS).
III. Prin structura chimică:
1. Proteine - constau doar din aminoacizi.
a) Albumine - solubile în apă, insolubile în soluții concentrate de săruri.
b) Globuline - insolubile în apă, solubile în soluții saline.
c) Histone - solubil în apă, în acizi puțin concentrați. Ele au pronunțate proprietăți de bază. Acestea sunt proteine nucleare, ele sunt legate de ADN și ARN.
d) Scleroproteinele - proteine ale țesuturilor suport (cartilaj, oase), păr, păr. Nu este solubil în apă, acizi slabi și alcali.
§ Colagenii sunt proteine fibrilare ale țesutului conjunctiv. Cu fierbere prelungită, se dizolvă în apă și gelatina se formează după gelifiere.
§ Elastinele sunt proteine ale ligamentelor și tendoanelor. Proprietățile sunt similare cu colagenii, dar sunt hidrolizate prin acțiunea enzimelor din sucul digestiv;
§ Keratin - face parte din păr;
2. Proteze - în plus față de AK, au o parte non-proteică (glico-, lipo, metal-, fosfo-, nucleo-, cromoproteine)
a) Nucleoproteine - grupare protetică - acizi nucleici. Dintre numeroasele clase de ribozomi nucleoproteinici sunt cele mai studiate, constând din molecule multiple de ARN si proteine ribozomale si cromatinei - celule eucariote miez nucleoproteine, constând dintr-un ADN și proteinele care formează structura - histone (conținute în nucleul celulei și mitocondrii).
b) Hemoproteinele - o componentă nonproteină a acestor proteome - heme, este construită din patru inele de pirol, împreună cu acestea un ion feros (prin intermediul atomilor de azot). Astfel de proteine includ: hemoglobină, mioglobină, citocromi. Această clasă de proteine este denumită și cromoproteine, deoarece hema este un compus colorat. Hemoglobina este transportul de oxigen. Myoglobina - depozitarea oxigenului în mușchi. Citocromii (enzime) - cataliza reacțiilor de reducere a oxidării și a transportului electronic în lanțul respirator.
c) Metaloproteinele - compoziția grupului protetic include metale. Citocromul a conține cupru, succinat dehidrogenază etc. Enzimele conțin fier neferos (ferodoxină).
d) Lipoproteinele - conțin lipide, fac parte din membranele celulare
e) fosforoproteine - conțin un reziduu de acid fosforic
f) Glucoproteinele - conțin zaharuri
Articole similare
Trimiteți-le prietenilor: