Scopul lecției
- explicați elevilor ce înseamnă formulele chimice. precum și conceptele de greutate atomică și moleculară relativă.
Obiectivele lecției
pentru a explica ce formule chimice arată, cum sunt compuse și ce înseamnă ei, pentru a înțelege conceptele de masă atomică și moleculară și diferențele dintre ele.
Termeni de bază
- Formulele chimice - caracterizează nu numai structura unei substanțe, ci și masele și cantitatea acesteia.
- Unitatea de masă atomică este egală cu 1/12 din masa unui atom de carbon 12C.
- Masa atomică relativă este o cantitate care nu are o dimensiune egală cu raportul dintre masa medie a unui atom al elementului chimic și 1/12 din masa unui atom de 12C.
- Masa absolută este egală cu masa atomică relativă înmulțită cu 1 amu.
- Masa moleculară relativă este o cantitate care nu are o dimensiune care să fie egală cu raportul dintre masa unei molecule a substanței chimice și 1/12 din masa unui atom de 12C.
- Masa absolută a unei molecule este egală cu masa moleculară relativă înmulțită cu 1 amu.
Partea 1. Formule chimice.
Formulele de substanțe chimice caracterizează, de asemenea, nu numai structura unei substanțe, ci și masele și cantitatea acesteia.
Fiecare formulă afișează fie o moleculă dintr-o substanță, fie un mol de substanță, fie o masă a unei substanțe care este egală (sau proporțională) cu masa sa molară. H2O, de exemplu, poate însemna ca o moleculă de apă și un mol de apă sau 18 unități de masă (de obicei 18 g) de apă.

Fig.2. Conceptul de formulă chimică.
Unitate de control 1.
1. Care sunt formulele chimice?
2. Care este diferența dintre formulele simple?
3. Cum arată formula chimică dacă compoziția atomică a unei molecule de substanță simplă nu este cunoscută?
Partea 2. Masa atomică relativă.
Calculând masa atomică relativă, trebuie luată în considerare abundența izotopilor elementelor din scoarța pământului.
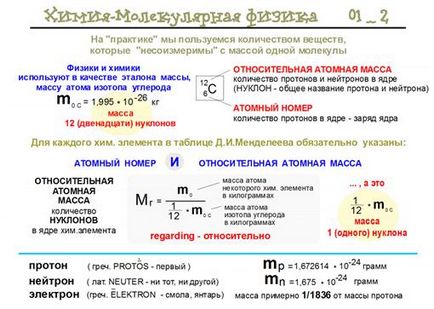
Fig. 4. Masa atomică relativă.
Masa absolută a unui atom al unui element chimic este egală cu masa atomică relativă înmulțită cu 1 amu:
m (CI) = 35.453 1.66057 10-24 = 5.8872 10-23g.
Unitate de control 2.
1. Ce sistem se utilizează pentru a calcula masa atomilor și a moleculelor?
2. Cum se determină unitatea atomică de masă a unui element chimic?
3. Cum se calculează masa atomică relativă a unui element chimic?
Partea 3. Masa moleculară relativă.
Greutatea moleculară relativă este egală cu suma masei relative a atomilor care alcătuiesc molecula.
(N2O) = 2Ar (N) + Ar (O) = 2 14,0067 + 15,9994 = 44,0128.

Figura 5. Greutate moleculară.
Masa absolută a moleculei este egală cu masa moleculară relativă înmulțită cu 1 amu.
Unitate de control 3.
1. Utilizând substanța chimică a unui element chimic, se calculează masa moleculară relativă?
2. Care este greutatea moleculară relativă?
3. Cum se calculează masa absolută a moleculei?
Calculați masele atomice și moleculare relative ale apei, oxigenului și aurului din spatele formulelor de mai sus.
Este interesant să știi că ...
Cu un amestec de substanțe organice (de exemplu, lemn) este necesar să se întâlnească destul de des. Toate substanțele organice conțin întotdeauna un element de carbon, care există în natură sub formă de diamant și grafit. Aproape cărbunul pur este, de asemenea, cărbune, funingine.
Compoziția zahărului include trei elemente chimice: carbon, hidrogen și oxigen. Când este încălzit, zaharul este ars, pierzând hidrogenul și oxigenul, care sunt eliberați sub formă de apă. Totuși, această eliberare de apă poate fi făcută nu numai prin încălzirea zahărului, ci și prin altă cale, de exemplu, folosind acid sulfuric concentrat în acest scop.
Acidul sulfuric concentrat este extrem de lacom pentru atașarea apei și îl poate lua de la mulți compuși. Acest lucru explică efectul carbonizant al acidului sulfuric asupra lemnului, hârtiei, zahărului etc.
Puneți 40 g de zahăr într-o pulbere fină și turnați-o într-un pahar îngust, adăugați aproximativ 3-4 ml de apă și amestecați bine cu o tijă de sticlă. Puneți sticla pe o placă, adăugați 20-25 ml de acid sulfuric concentrat și amestecați din nou bine amestecul. După câteva minute amestecul va începe să se întunece, se va încălzi, vaporii de apă vor lăsa sticla și va începe să se formeze o masă slabă, care se va ridica din sticlă sub forma unei coloane. Masa care se formează în acest caz este un cărbune foarte poros, derivat din zahăr. Reacția eliberează și oxidul de sulf (IV), care se formează datorită reducerii acidului sulfuric prin cărbune.
Gazele și vaporii de apă formați în timpul reacției determină umflarea zahărului cărbunelui.
Lista literaturii utilizate
Puteți pune întrebarea despre educația modernă, puteți exprima o idee sau puteți rezolva o problemă urgentă la Forumul Educațional. unde la nivel internațional se adună un consiliu educațional de gândire și acțiune proaspătă. Prin crearea unui blog, va spori nu numai statutul său ca un instructor calificat, dar, de asemenea, aduce o contribuție semnificativă la dezvoltarea școlii viitoare. Liderii Alianței Educație își deschide porțile pentru profesioniștii din cel mai înalt rang, și invită să coopereze pentru crearea celor mai bune școli din lume.
Articole similare
Trimiteți-le prietenilor: