Când se dizolvă în apă, compușii complexi se dezintegrează, în mod obișnuit, astfel încât sfera internă se comportă ca un întreg:
K [Ag (CN) 2] K + [Ag (CN) 2] -
Împreună cu acest proces, deși într-o măsură considerabilă, are loc disocierea sferei interne a complexului: [Ag (CN) 2] - Ag + + 2CN -
Aplicând expresia constantei de ionizare la ultimul echilibru, obținem relația numită instabilitatea complexului:
Constanta de instabilitate este măsura puterii complexului. În locul constantei de instabilitate, uneori se folosește o cantitate inversă, numită constantă de stabilitate:
Pentru un număr de compuși care sunt considerați complexe, constantele de instabilitate sunt atât de mari încât concentrațiile particulelor constituente sunt mai mari decât concentrația ionului complex. Acești compuși includ săruri duble, care în stare solidă au o structură de coordonare și în soluție se descompun într-o mare măsură în ioni compuși, de exemplu:
K2 [CuCI4] 2K + + [CuCI4] 2K + + Cu2 + + 4CI -
În soluțiile moderat diluate ale acestei sări, există atât ioni complexe cât și simple. Dilatarea ulterioară conduce la descompunerea completă a ionilor complexi [CuCl4] 2-.
Chelați. Efectul de chelare
Compușii ciclici foarte importanți includ așa-numiți chelați sau compuși asemănători ghearelor în care un atom central și un ligand polidentant formează un ciclu. De exemplu, interacțiunea dintre hidroxidul de cupru și acidul aminoacetic formează un complex neutru:
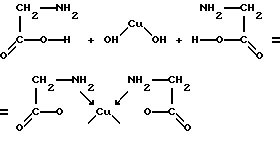
Fiecare moleculă de acid aminoacetic utilizează ambele grupuri funcționale. Într-un caz se conecteaza la atomul central prin cele două grupări amino ale mecanismului donor-acceptor și în al doilea - gruparea carboxil prin oxigen legătură covalentă convențională. Agentul de complexare este, așa cum a fost, atras în ligand, acoperit de legături precum gheara unui cancer. De aici chela numele. Exemple de alte chelati pot fi complexați cu etilen diamină NH2-C2H4-NH2, acid etilendiaminotetraacetic (EDTA), acid oxalic.
Chelații sunt, de asemenea, importanți pentru compușii de viață, cum ar fi clorofila și hemoglobina:
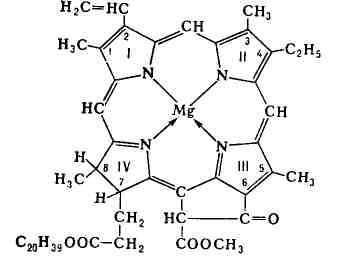
Agentul de complexare în clorofil este magneziu și în hemoglobină - fier. În același plan ca metalul, există patru atomi de azot ai ligandului organic. Pe cealaltă parte a planului fier, atașăm molecula de proteine (globină), iar pe cealaltă moleculă de oxigen. Un astfel de produs se numește oxihemoglobină. Se formează în plămâni, unde hemoglobina atașează oxigenul la aer și apoi se extinde pe tot corpul sub formă de oxihemogloban. Clorofila joacă un rol crucial în procesele de fotosinteză care apar în toate plantele verzi.
Prezența grupărilor ciclice în chelați crește puternic stabilitatea lor în comparație cu compușii cu compoziție similară, dar fără cicluri. Această creștere a stabilității se numește efect de chelare. Acest termen a fost inventat in 1952 G.Shvartsenbahom an pentru explicarea observată experimental fapt o stabilitate semnificativ mai mare a complecșilor de ioni metalici cu reactiv polidentată comparativ cu complecși ai acestor aceleași metale cu liganzi monodentați. Efectul de chelare (CHE) este exprimat cantitativ prin următoarea relație:
unde Z este ligandul m-dentat și lg # 946; MAm = lgKMA1 + lgKMA2 + ... + lgKMAn
Efectul chelator - este diferența dintre logaritmii constantele de stabilitate si constanta de ansamblu stabilitate Chelat a complexului format cu același ion metalic cu ligandul monofuncțional corespunzător.
G.Shvartsenbakh a propus așa-numita interpretare entropică a efectului de chelatare. Din considerente fizico-chimice generale
# 916; Go = -RTlnK = # 916; Ho-T # 916;
Schwarzenbach credea că stabilitatea ridicată a chelaților cu liganzi polidentați este asociată cu o creștere a contribuției entropice la energia liberă de formare complexă. Pentru complexele cu liganzi monodentați, reacția de formare poate fi scrisă după cum urmează:
în timp ce pentru liganzii multidentați procesul va merge puțin diferit:
Conform acestor ecuații asupra complexare cu liganzi monodentați număr total de particule plutitoare nu este schimbat într-o soluție și în cazul polidentată - crește, ceea ce duce la o creștere a entropiei sistemului.
Articole similare
-
Cum să conduceți arborii cardanici (broaște și spline) cât de des este necesar
-
Amestecarea plăcilor și a laminatului - cum se face o îmbinare
-
Desenarea elementelor de fixare și a conexiunilor acestora - desene tehnice
Trimiteți-le prietenilor: