
Acasă | Despre noi | feedback-ul
Motivul pentru apariția izomerismului geometric este absența rotației libere în jurul valorii de # 963; comunicare. Acest tip de izomerism este caracteristic compușilor care conțin o dublă legătură și pentru compușii din seria aliciclică.
Izomerii geometrici sunt substanțe care au aceeași formulă moleculară, aceeași secvență de legare a atomilor în molecule, dar care diferă una de cealaltă prin poziții diferite de atomi sau grupuri atomice în spațiu față de planul dublei legături sau planul ciclului.
Motivul pentru apariția acestui tip de izomerism este imposibilitatea de rotație liberă în jurul unei legături duble sau - conexiuni care formează un ciclu.
De exemplu, butene-2 CH3-CH = CH-CH3 poate exista ca doi izomeri, care diferă în aranjamentul grupărilor metil în spațiu față de planul dublei legături.
sau 1,2-dimetilciclopropan există ca doi izomeri, Koto-secară aranjament diferit de grupări metil în spațiu cu ciclu în plan relativ:
Pentru a indica configurația izomerilor geometrici, se utilizează un sistem cis-trans. Dacă aceiași substituenți sunt localizați pe o parte a planului dublu de legare sau ciclu, configurația este denumită cis. dacă pe laturi opuse - trans-.
Izomerismul constituțional (rotativ) se datorează rotației atomilor sau grupurilor atomice în jurul uneia sau mai multor simple # 963; - conexiuni. Ca urmare a rotirii în jurul legăturilor C-C, moleculele pot avea forme spațiale diferite, numite conformații.
De exemplu, o moleculă de etan din cauza rotației în jurul legăturii carbon-carbon poate lua un număr infinit de conformații. fiecare dintre acestea fiind caracterizată de o anumită valoare a energiei potențiale. Două conformații extreme sunt numite ocluzate și inhibate.
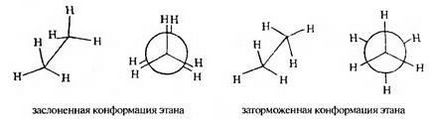
In Eclipsata atomii de hidrogen conformație etan de grupări metil, așa cum este văzută de-a lungul legăturile carbon-carbon, sunt dispuse unul în spatele celuilalt. În atomul de hidrogen inhibat - atomii de hidrogen ai unei singure grupări metil sunt îndepărtate maxim din atomii de hidrogen ai celuilalt. Între conformarea ocluzată și inhibată, molecula are multe conformații în timpul procesului de rotație.
Fiecare dintre conformațiile moleculei de etan este caracterizată de o energie potențială diferită. Conformația ecranată are o energie maximă, iar conformația inhibată are o energie minimă.
conformație inhibate în care grupările metil (substituenți de volum LARG) distanțate la maximum unul de altul, numit anti-conformație. O altă conformație inhibată este numită o conformație înfricoșătoare.
Conformarea inhibată de șobolan are o energie potențial mai mare (datorată interacțiunii metil-metil) decât anconformația (în acest caz nu există interacțiune între metil).
Conformațiile cu cea mai mică rezervă de energie se numesc conformeri sau izomeri conformaționali (rotativi).
Astfel, n-butan, la 25 ° C, există aproximativ 70% sub formă de conformer anti și 30% gauche-conformer.
Spre deosebire de izomerii de configurație, conformerii sunt transformați unul în celălalt fără a rupe legăturile chimice și nu pot fi separați. Ele sunt detectate numai prin metode fizico-chimice.
Articole similare
-
Ce figură geometrică este fața ta pentru portalul femeilor moderne
-
Isomerismul - o enciclopedie rusească mare - versiunea electronică
Trimiteți-le prietenilor: