Definiția și formula oxidului de fosfor
oxid de fosfor (anhidridă fosforic) (fosfor are o valență (V) și starea de oxidare +5) în condiții normale este albă foarte higroscopice (puternic agent de deshidratare) cristale (Fig. 1).
Există, de asemenea, în stare amorfă (sub formă de fulgi) și stare vitroasă. Când este încălzit, oxidul de fosfor cristalin (V) se sublimează. Se topește numai sub presiune excesivă, trece într-un fluid care se mișcă ușor.

Fig. 1. Oxid de fosfor (V). Aspect.
După încălzire suplimentară, se polimerizează, când se răcește un lichid, se formează un produs sticlos. Punctul de topire este 422 ° C, punct de fierbere 591 ° C.
Are proprietăți acide, reacționează puternic cu apă și alcaline.
Formula chimică a oxidului de fosfor
Formula chimică a oxidului de fosfor (V) P2O5. Aceasta arată că structura acestei molecule conține doi atomi de fosfor (Ar = 31 amu) și cinci atomi de oxigen (Ar = 16 amu). Conform formulei chimice poate fi calculată de oxid de fosfor greutate moleculară (V):
Mr (P2O5) = 2 × 31 + 5 × 16 = 62 + 80 = 142.
Formula grafică (structurală) a oxidului de fosfor
Formula structurală (grafică) a oxidului de fosfor (V) este mai evidentă. Arată cum sunt atomii legați între ei în interiorul moleculei (Figura 2). Oxidul de fosfor (V) poate dimeriza (corespunde formulei chimice P4O10), iar existența sa în această formă este cea mai preferată.
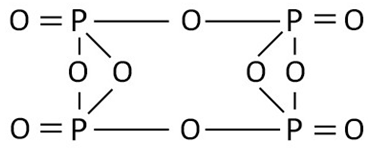
Fig. 2. Formula grafică a oxidului de fosfor (V).
Exemple de rezolvare a problemelor
Când au fost arse 2,3 g de materie organică constând din carbon, hidrogen și oxigen, s-au format 4,4 g dioxid de carbon și 2,7 g apă. Densitatea vaporilor substanței în raport cu oxigenul este de 1,44 g. Se determină formula moleculară a substanței.
Masa molară a unei hidrocarburi poate fi determinată prin densitatea de oxigen:
Materialul = 32 x 1,44 = 46 g / mol.
În greutate dioxid de carbon și apă descoperim masa carbonului și a hidrogenului și oxigenului (prin diferența dintre greutatea substanței și a atomilor de carbon și hidrogen din aceasta). Cu toate acestea, pentru început, calculăm masele lor moleculare. După cum se știe, masa molară a unei molecule este egală cu suma masei atomice relative a atomilor care alcătuiesc molecula (M = Mr):
M (CO2) = Ar (C) + 2 x Ar (O) = 12 + 2 x 16 = 12 + 32 = 44 g / mol;
M (H2O) = 2 x Ar (H) + Ar (O) = 2 x 1 + 16 = 2 + 16 = 18 g / mol.
m (C) = 4,4 x 12/44 = 1,2 g.
m (H) = 2,7 x 2 x 1/18 = 0,3 g.
m (O) = substanță - m (C) - m (H) = 2,3 - 1,2 - 0,3 = 0,8 g.
Notăm numărul de moli de elemente ale conexiunilor pentru „x“ (carbon) „y“ (hidrogen) și «z» (oxigen). Apoi, raportul molar va arăta astfel:
x: y: z = m (C) / Ar (C). m (H) / Ar (H). m (0) / Ar (O);
x: y: z = 1,2 / 12. 0,3 / 1: 0,8 / 16;
x: y: z = 0,1. 0,3: 0,05 = 2,6.
De aceea, cea mai simplă formulă a compusului organic are forma masa molară C2 H6 Oand 46 g / mol [M (C2 H6 O) = 2 x Ar (C) + 6 × Ar (H) + Ar (O) = 2 x 12 + 6 × 1 + 16 = 24 + 6 + 16 = 46 g / mol].
Pentru a găsi adevărata formulă a unui compus organic, găsim raportul dintre masele moleculare obținute:
Prin urmare, formula pentru compusul organic va fi C2H6O.
Trimiteți-le prietenilor: