Pregătirea pentru UPE. Chimie.
Rezumat 5. Structura atomului
Istoria descoperirii structurii atomului
La sfârșitul secolului XIX - începutul secolului XX, fizicienii au demonstrat că atomul este o particulă complexă și constă din particule mai simple (elementare). Am gasit:
1. Grinzi catodice (fizicianul englez JJ Thomson, 1897),
2. Particulele care se numesc electroni e - (poartă o sarcină negativă a unității);
3. Radioactivitatea naturală a elementelor (oamenii de știință francezi - radiochemists A. Becquerel și M. Sklodowska-Curie, fizicianul Pierre Curie, 1896) și existența particulelor α (nuclei de heliu);
4. prezența în centrul atomului a unui nucleu încărcat pozitiv (fizicianul englez și radiochemistul E. Rutherford, 1911);
5. conversia artificială a unui element la altul, de exemplu oxigen azot (E. Rutherford 1919 YG). Un element al nucleului atomic (azot - în experimentul Rutherford) in urma impactului cu nucleul α-particula a fost format din alți atomi membri (oxigen) și noi particule care transportă unitatea de sarcină pozitivă, numită proton (nucleu)
6. Prezența în nucleul unui atom de particule neutre din punct de vedere electric - neutroni (fizicianul englez J. Chadwick, 1932).
Ca rezultat al studiilor efectuate sa stabilit că protonii sunt prezenți în atomul fiecărui element (cu excepția H). neutronii și electronii.
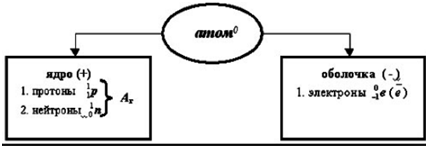
Structura atomului.
Iar protonii și neutronii sunt concentrați în nucleul atomului, iar electronii - pe periferia sa (în coajă de electroni).
Numărul de protoni din nucleu este egal cu numărul de electroni din carcasa atomului și corespunde numărului ordinal al acestui element în sistemul periodic.
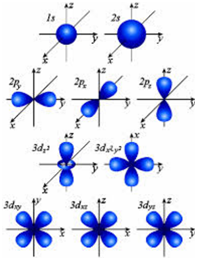
Coajă electronică a unui atom
Coaja de electroni a unui atom este un sistem complex. Este împărțită în subgrupuri cu diferite energii (niveluri de energie); nivelele, la rândul lor, sunt împărțite în subsoluri, iar subsolurile includ orbitale atomice, care pot să difere în formă și dimensiune (denotate de literele s, p, d, f etc.).
Forma s-orbitală este sferică. Forma p-orbitalilor (numărul lor pe p-subsol este de 3) este în formă de gantere. Forma d-orbitalilor (a căror număr pe d-subsub corespunzătoare este de 5) este mult mai complicat. Și mai complicată este forma f-orbitalilor, al cărui număr pe f-subsub este de 7.
Forme ale orbitalilor atomici.
Numărul maxim de electroni la nivelul energiei este determinat de formula N = 2n². Unde n este numărul de nivel de energie.
Ordinea de umplere a nivelului electronilor de atomi de perioade mici
Pentru a elabora o schemă pentru structura coajelor de electroni ale atomilor, trebuie să urmăm următorul algoritm:
A. determină numărul total de electroni pe coajă cu numărul ordinal;
B. determină numărul de niveluri de energie cu numărul perioadei;
B. determină numărul de electroni la fiecare nivel de energie (folosind formula 2n²)
Pe carcasa electronică exterioară a elementelor din subgrupul principal, numărul de electroni corespunde numărului grupului;
În cazul elementelor din subgrupul secundar de pe stratul electronic 2 exterior al electronului, stratul electronic penultim este umplut.
Atomul de hidrogen are numărul de serie 1, prin urmare, are un electron. Atomul este în 1 perioadă, prin urmare, în atom există un nivel de energie. Schema de distribuție a electronilor față de nivelurile de energie:
)
Înregistrăm încărcarea nucleului atomic, apoi punem brațul simbolizând nivelul electronic, alături de brațul din dreapta jos, scriem numărul de electroni la un anumit nivel.
Distribuția electronilor peste nivelurile de energie poate fi scrisă diferit:
Atomul de heliu are numărul ordinal 2, prin urmare, are 2 electroni. Atomul este în 1 perioadă, prin urmare, în atom există un nivel de energie. Schema de distribuție a electronilor față de nivelurile de energie:
El + 2) 2 sau
Atomul de litiu are numărul de ordine 3, prin urmare, are 3 electroni. Trei electroni nu se pot potrivi la primul nivel de energie, deoarece capacitatea sa maximă este 2e- (conform formulei 2n²). În consecință, al treilea electron va forma al doilea strat energetic. Acest strat va avea o rază mai mare decât prima. Aceasta corespunde într-adevăr poziției de litiu în sistemul periodic de elemente chimice. Atomul se află în a doua perioadă, prin urmare, în atom există două niveluri de energie. Schema de distribuție a electronilor față de nivelurile de energie:
Li + 3) 2) 1 sau 1
Argumentând, prin urmare, considerăm schema de umplere a nivelurilor de energie pentru unele elemente de perioade mici:
Proprietățile elementelor se repetă periodic, deoarece atomii elementelor repetă periodic numărul de electroni pe stratul electronic exterior.
Ordinea de umplere a nivelului de electroni de atomi de perioade mari
Compoziția celei de-a doua și a treia perioade cuprinde 8 elemente. În compoziția celei de-a patra perioade intră în mai mult de 10 elemente, adică A patra perioadă cuprinde 18 elemente. Unde sunt electronii plasați în elemente după calciu? Reamintim că elementele grupelor D sunt metale, caracterizate prin valența II. Singurul lucru care poate fi sugerat este continuarea umplerii penultimului strat electronic. Deci, pentru scandiu, ne putem imagina următorul model al structurii atomului:
Sc +21))))
2 8 9 2
Zece elemente "superficiale" din perioada a 4-a sunt completate de un atom de zinc. Pe stratul electronic exterior al acestui element există doi electroni, iar pe penultimul strat - 18.
Zn +30))))
2 8 18 2
Datorită faptului că pe penultimul strat electronic în elementele celei de-a patra perioade este posibil să se aranjeze încă 10 electroni, în a patra perioadă există 10 elemente chimice mai mult decât în al treilea.
concluzii:
1. Numărul de straturi electronice din atomul elementului este egal cu numărul perioadei în care este localizat acest element.
2. Pentru elementele grupelor A, numărul grupului căruia îi aparține este egal cu numărul de electroni externi ai atomului.
3. Repetabilitatea periodică a proprietăților elementelor se datorează faptului că în tranziția de la perioadă la perioadă începe să se umple un nou strat electronic, adică se repetă periodic numărul de electroni externi de pe stratul electronic extern.
4. Existența unor perioade mari se explică prin umplerea electronilor penultimului (intern) electronic.
Diagrama grafică a structurii straturilor electronice ale atomilor (formula electronică-grafică)
Pentru a descrie localizarea electronilor în orbitalii atomici, utilizați configurația electronică.
Pentru a scrie în linie, orbitele sunt scrise în notele convenționale (s-, p-, d-, f- orbitale) și înaintea lor numere care indică numărul de nivel de energie. Cu cât numărul este mai mare, cu atât electronul este mai departe de nucleu. În registrul superior, deasupra desemnării orbitalilor, se scrie cantitatea de electron aflată pe orbitele date.
Configurația electronică a atomului de scandiu.
Electronii de nivelul energiei externe se numesc electroni de valență.
se referă la elementele d.
Din punct de vedere grafic, distribuția electronilor în orbitele atomice poate fi reprezentată sub formă de celule.
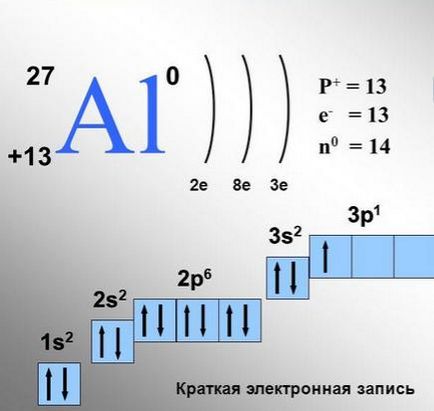
Distribuția electronilor într-un atom de aluminiu.
Fiecare celulă corespunde unei singure orbite. Vor exista trei astfel de celule pentru orbitele p, cinci pentru orbitele d și șapte pentru orbitele f. O celulă poate conține 1 sau 2 electroni.
Există, în general (numită regulă Gunda) la care electronii preferă să se așeze pe aceeași orbitali de energie umplere a începe aceste orbitali (de exemplu, tri-orbitali p) sunt mai întâi în mod individual, și numai atunci când fiecare dintre aceste orbitali este deja un electron, al doilea electroni.
Atunci când orbita este populată de doi electroni, astfel de electroni sunt numiți perechi. Electronii le vor popula astfel încât fiecare dintre aceste orbite p va avea câte un electron. Acest lucru se explică prin faptul că în celulele vecine electronii se repetă reciproc mai puțin, ca particule încărcate de același nume.
Teste de pregătire pentru ZNO:
Test de pregătire online pentru ZNO pe chimie № 5 "Structura atomului"
Trimiteți-le prietenilor: