Distribuția Maxwell
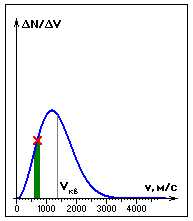
Dacă măsuram simultan vitezele unui număr mare de N de molecule de gaze și separăm un interval mic de viteze de la v la v + v, atunci un anumit număr de N de molecule intră în intervalul separat v. Pe grafic este convenabil să se descrie dependența cantității de viteza v. Pentru un număr suficient de mare N, această dependență este reprezentată de o curbă netedă având o viteză maximă (viteza cea mai probabilă). Aici m este masa moleculei, este constanta Boltzmann.
Un parametru caracteristic al distribuției lui Maxwell este așa-numita viteză medie pătrată, adică valoarea medie a pătratului vitezei. În fizica moleculară se dovedește acest lucru
unde este masa molară.
Din expresia vitezei medii-pătrat rezultă că energia cinetică medie a mișcării translaționale a moleculelor de gaz este
Distribuția Maxwell este una dintre cele mai importante legi statistice ale fizicii moleculare.
Bordul lui Galton (justificarea experimentală)
Pentru a înțelege mai bine natura statistică a problemei distribuției vitezelor moleculare, poate servi un instrument numit placa Galton. Aceasta este o placă acoperită din față cu sticlă, în care unghiile sunt adesea blocate într-o ordine eșalonată. Deasupra unghiilor din mijlocul plăcii se află o pâlnie în care se pot turna nisip, bob de mei sau alte particule. Dacă aruncați o particulă în pâlnie, atunci când cade, va avea parte de multe coliziuni cu unghii și va cădea la masă la o anumită distanță de centrul tablului (vezi animația). La ce distanță de centrul plăcii va cădea particula, este imposibil de prezis din cauza multitudinii de factori aleatorii care îi afectează mișcarea. Putem vorbi doar despre probabilitatea de deviere a unei particule la o anumită distanță. Este normal să se aștepte că căderea particulei în partea centrală a mesei este mai probabilă decât la margini. Într-adevăr, în cazul în care particulele printr-o pâlnie pentru a turna în mod continuu, se pare că în partea centrală a secțiunii situată sub deschiderea pâlniei, se acumulează cel mai mare număr de particule, iar marginile de bord opuse le este foarte mic. Cu un număr foarte mare de particule care trec prin pâlnie, o regularitate statistică destul de clară a războaielor de distribuție. Se pare că pentru un număr foarte mare de particule curba se apropie asimptotic de o curbă a formei
unde A și a sunt constante, iar formula însăși exprimă așa-numita lege normală de eroare Gaussiană (1777-1855). Vitezele moleculelor de gaz sunt distribuite conform aceleiași legi și determinând constantele A și a pentru un gaz din condițiile de normalizare și alte ipoteze suplimentare pe care le ajungem la distribuția Maxwell.
Referințe:
1. Sivukhin D.V. Cursul general al fizicii. Termodinamica și fizica moleculară, ed. Moscova, 1979, pag. 72-74
2. Născut M. fizica atomică, trans. cu engleza. 3 ed. Moscova, 1970
Acest site a fost creat cu uCoz
Trimiteți-le prietenilor: