
Acasă | Despre noi | feedback-ul
În solide, atomii sunt aranjați în ordine relativă (fiecare relativ la restul), care este asigurată de prezența unor legături permanente între ele. Ecuația cuantică-mecanică Schrödinger care descrie natura mișcării electronilor într-un atom face posibilă explicarea naturii legăturilor care apar între atomi în formarea structurii cristaline a solidelor. Cu o aproximare suficientă a atomilor (moleculelor), se produce o interacțiune între ele, ducând la apariția unor forțe atractive și respingătoare.
Cel mai general tip de legătura dintre atomi și molecule este forțele van der Waals. Pentru prima dată, aceste forțe au fost introduse pentru a explica scăparea gazelor reale din ecuația de stare a gazelor ideale. De aici și numele lor. În ecuația lui Van der Waals
aceste forțe determină corecția (a / V 2). Corecția b ia în considerare acțiunea forțelor respingătoare.
O proprietate remarcabilă a forțelor Van der Waals este aceea că ele apar între sisteme neutre și sisteme care nu au un moment electric. În interacțiunea dintre gazele inerte ele sunt singurele forțe care fac posibilă existența unei stări lichide și solide a acestor substanțe.
Atomii care stau în sistemul periodic Mendeleev alături de gazele inerte tind să accepte configurația lor dând sau luând electroni. În metalele alcaline, care sunt direct în spatele gazelor inerte, electronul de valență se mișcă în afara stratului umplut și se leagă slab de nucleu. La halogeni situați chiar înaintea gazelor inerte, lipsește un electron pentru a umple un strat stabil de gaz nobil. Prin urmare, au o mare afinitate pentru electronul suplimentar.
Legătura dintre astfel de atomi, adică între metalele tipice și halogenurile, se efectuează după cum urmează. La început începe ionizarea ambilor atomi: electronul de la atomul de metal trece la atomul de halogen. În acest caz, atomul de metal se transformă într-un ion încărcat pozitiv, atomul de halogen într-un ion încărcat negativ. Acești ioni interacționează între ei în conformitate cu legea lui Coulomb, ca două acuzații diferite. Această conexiune se numește ionică sau polară.
Existența a două tipuri de obligațiuni (legăturile polar și van der Waals) nu poate explica existența unui solid solid. În special, atomii omogene nu se pot forma, în mod evident, prin ioni încărcat oppositely redistribuirea electronilor de valență, așa cum este cazul în interacțiunea cu halogenuri metalice. De fapt, pentru solidele formate din atomi identici, tipul de legături covalente este realizat. Acest tip de conexiune se numește și homeopolar și schimb.
O legătură covalentă apare atunci când atomii de aceeași natură (de exemplu atomul A și atomul B) converg. Luați în considerare fiecare dintre acești atomi doi electroni de valență (1 și 2). Nucleul acestor atomi este notat cu a și b. Datorită faptului că densitatea norului de electroni, care descrie starea unui electron dintr-un atom, ea scade rapid cu distanta, găsirea unui electron în nucleu 1 b, un electron 2y miez ca fiind extrem de improbabil. Calculul arată că la r = 50 A, fiecare dintre electroni poate vizita nucleul "străin" o dată pe o medie de 10 12 ani. Prin urmare, atomii A și B pot fi considerați izolați și energia unui sistem format din astfel de atomi ar trebui să fie luată egală cu 2E0, unde E0 este energia unui atom izolat în stare normală.
Pe măsură ce atomii se apropie, probabilitatea transferului de electroni către nucleele "străine" crește. La o distanță suficient de mică între nucleele atomilor are loc o suprapunere apreciabilă a norilor de electroni ai atomilor și tranzițiile da frecvență este crescută timp de aproximativ 14 secunde la aproximativ 10 -1. Cu aproximație suplimentară a gradului de suprapunere nori de electroni și crește frecvența de site-uri de schimb crește, astfel încât fără sens să vorbim de un electron la un atom aparținând 1 A. 2k atom și electron V. Aceasta corespunde la apariția unei noi condiții, nu este caracteristic unui sistem format din doi atomi izolați și remarcabil prin faptul că electronii din acest stat apar simultan ambelor nuclee sau, cum se spune, sunt socializați.
Există un alt fel de relație între aceleași legături atomice - metalice. O astfel de conexiune este caracteristică pentru metale: la nodurile rețelei metalice există ioni încărcați pozitiv, legătura chimică dintre care este realizată cu ajutorul electronilor liberi care formează un gaz de electroni. O legătură metalică apare atunci când numărul de electroni de valență este mic și sunt mai slabi în raport cu nucleele. Atunci când se formează metale, cochilii de electroni ai electronilor de valență se suprapun, astfel încât electronii de valență sunt capabili să se miște de la un atom la altul și să se miște liber peste tot în cristal. Electronii liberi leagă pozitiv ionii într-o structură puternică. Legătura metalică este mai flexibilă și mai plastică decât legătura ionică. În metale, are loc socializarea electronilor; acești electroni sunt tot timpul între atomi. În cazul unei legături metalice, în socializarea electronilor de valență, toți atomii de cristal participă, iar electronii socializați nu se localizează la atomii lor, ci se mișcă liber în întreaga rețea.
Trebuie remarcat faptul că legătura cea mai universală este conexiunea Van der Waals. Apare în toate cazurile fără excepție. În același timp, ea - cea mai slabă legătură cu energia care să nu depășească-edi jos 10 martie 8 × J / mol.V formă pură apare în atomii și moleculele care au vnut-Rennie coji de electroni umplut neutre interacțiune Corolarului. În special, Van der Waals forță determină existența stărilor lichide și solide, gaze inerte, hidrogen, oxigen, azot și mulți compuși organici și anorganici, care asigură o legătură într-un grup vast ne valență cristale moleculare; acest lucru va fi descris mai detaliat mai jos. Datorită faptului că energia de legătură a van der Waals este scăzută, toate structurile cauzate de această legătură sunt ieftine, ușor volatile și au puncte de topire scăzute.
Legarea ionică este o legătură chimică tipică larg răspândită între compușii anorganici. Acestea includ compuși ai metalelor cu halogenuri, oxizi metalici, sulfuri și mulți alți compuși polari. Legarea ionică este, de asemenea, inerentă în numeroși compuși intermetalici (carburi, selenide, nitruri etc.). Energia legăturii ionice este mult mai mare energie forțe Van der Waals: aceasta variază de la aproximativ 6,7 x brumărel 5 J / mol (de KCl) până la 7 1.5-10 J / mol (pentru oxid de alu-minum și crom). Prin urmare, solidele cu o legătură ionică au încălziri de sublimare ridicate și puncte de topire ridicate.
Legătura covalentă este extrem destul de răspândită-nenie în compuși organici, dar este de asemenea găsit în compuși neorganici, unele metale, și în setul-GIH compuși intermetalici. Această legătură determină ob transformarea cristalelor de tip valență de diamant, germaniu, etc. valență energie bond este mare: .. O singură legătură „carbon - carbon“ (C - C) în compuși organi-ically are o energie de ordinul 3-10 5 J / mol. Aceeași valoare are, de asemenea, această relație în zăbrelea diamantului, după cum o demonstrează temperatura ridicată de topire și căldura ridicată de sublimare.
În sfârșit, legătura metalică rezultată din socializarea electronilor de valență este caracteristică metalelor tipice și a multor compuși intermetalici. Energia acestei legături este comparabilă în ordinea magnitudinii cu energia legăturii de valență.
Trebuie subliniat faptul că în solide reale, fiecare dintre legăturile considerate în formă pură aproape nu apare niciodată. Aproape întotdeauna există o suprapunere a două sau mai multe tipuri de legături. Unul dintre ei, de regulă, predomină, determinând structura și proprietățile corpului.
Pentru a descrie structura internă corectă a solidelor, folosiți conceptul de latură spațială sau cristalină.
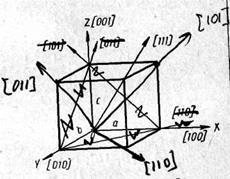
Din datele din acest tabel se vede că, în funcție de direcție, proprietățile cristalului pot varia foarte puternic.
În concluzia acestei prelegeri, să luăm în considerare diferențele în proprietățile fizice ale solidelor monocristaline și policristaline.
În condiții speciale, un corp solid poate crește sub forma unui singur cristal - un singur cristal. Cu toate acestea, mult mai des apar în topitură un număr mare de centre de cristalizare, ceea ce dă naștere creșterii unui număr mare de cristale individuale. Crescând, se converg treptat unul la altul, cresc împreună și formează un conglomerat solid - policristalin. Cristaliții intergrupați (granule) sunt de obicei sub formă de poliedra neregulată, a cărei tăietură exterioară nu reflectă deloc structura lor internă corectă. Deoarece distribuția și orientarea centrelor de cristalizare în topitura răcită sunt complet aleatorii, atunci orientarea granulelor intergrata relativ una față de cealaltă este de asemenea aleatoare. Prin urmare, policristalul nu prezintă o dependență apreciabilă a proprietăților pe direcție - este izotropă.
În plus, diferența de boabe de orientare intergrows conduce la limitele grăunților, anihilării-ing o puternică influență asupra formării proprietăților mecanice în agregate policristaline. Chiar și într-un metal extrem substanțial pur care nu conține impurități în rețeaua cristalină este intercalații intercristaline distorsionate. Distorsiunea nu se limitează la un singur strat de atomi limitați, ci se extinde la mai multe straturi adânci cu care atomii limită interacționează. Cu cât este mai mare gradul de dezorientare a boabelor limită, cu atât este mai mare zona de tranziție și cu cât este mai distorsionată.
Distorsiunea laturii cristaline în straturile intercristaline este motivul localizării cantității excesive de energie liberă în ea. Acest lucru este confirmat de o serie de experimente. Astfel, Chalmers a stabilit că pentru carton foarte pur granițele încep să se topească la o temperatură ușor mai mică decât boabele în sine. Viteza de difuzie de-a lungul granițelor granulelor este mai mare decât în volum. Nucleația de noi boabe în timpul recristalizarea începe, în general, la limitele vechi sau în locuri în care deformarea plastică cea mai severă scurgeri, la-duse la o perturbare a rețelei cristaline. Dacă impuritatea metalică cu adăpostirii, atunci când aceste impurități sunt alocate de cristalizare, de obicei, la limitele granulei, ceea ce duce la apariția unor straturi intercristaline, compoziția sa și proprietățile dramatic Otley-din boabe ei înșiși consecventă.
Articole similare
-
Caracteristica structurii și proprietăților hârtiei - istoria producției de hârtie și hârtie
-
Enciclopedia de tribologie - interacțiunea suprafețelor solide cu mediul
-
Coasta - proprietăți utile ale hârtiei - structura și proprietățile hârtiei
Trimiteți-le prietenilor: