1. Formarea sărurilor
Acizii organici formează săruri cu metale, oxizi, carbonați, hidrocarburi și alcalii, de exemplu:
CH3COOH + NaOH®CH3COONa + H20
2. Formarea anhidridelor halogen
Sub acțiunea halogenurilor fosforice, acizii carboxilici formează anhidride (hidroxilul este înlocuit cu halogen):
CH3COOH + PCI5®CH3COCl + POCI3 + HCI
Clorurile acide pot fi de asemenea preparate prin acțiunea acizilor carboxilici de clorură de tionil:
CH3COOH + SOCl2®CH3COCl + S02 + HCI
Acizii carboxilici pot fi restabiliți doar cu ajutorul unor agenți reducători foarte puternici, prin urmare, alcoolii primari (și nu aldehidele) se formează întotdeauna ca produse de reacție:
CH3COOH + LiAIH4®CH3CH2OH
Acizii carboxilici pierd foarte ușor dioxidul de carbon. De regulă, se formează o hidrocarbură. Acizii carboxilici alifatici sunt decarboxilați în prezența unor catalizatori diferiți care conțin cupru. CH3CH2COOH®CH3CH3 + C02.
Reacțiile de decarboxilare includ sinteza lui Kolbe (vezi Lectura 2).
În prezența unui acid puternic (de exemplu, acidul sulfuric), acizii carboxilici dau esteri cu alcooli:
CH3COOH + CH3CH2OH "CH3COOCH2CH3 + H20
Ca rezultat al reacției, se formează un amestec de echilibru. Pentru a schimba echilibrul spre formarea produsului, se utilizează un exces mare de alcool sau apa se îndepărtează în timp ce se formează.
Mecanismul de esterificare este o reacție de scindare adițională (substituție acil nucleofilă) Protonul, care este un catalizator, facilitează atacarea grupării carbonil prin nucleofil:
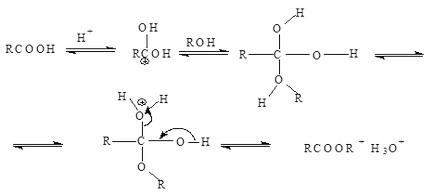
Acid formic. Se obține din sarea de sodiu (formatul), care se formează prin trecerea monoxidului de carbon printr-o soluție de alcalii de 25-30%
NaOH + COHHCOONa
Suspensia de formiat de sodiu este apoi descompusă cu acid formic.
Acidul formic este utilizat pentru prepararea catalizatorilor, în medicină și într-o serie de sinteze. Dintre derivații săi, cea mai importantă este N, N-dimetilformamida HCON (CH3) 2. Este un solvent selectiv în separarea acetilenei de amestecurile de gaze și cu absorbția HCl, SO2, CO2 și a altor gaze.
Acidul formic are multe proprietăți chimice ale acizilor, dar are și anumite caracteristici specifice:
1. este un agent de reducere bun (usor oxidat):
HCOOH + HgCl2 → Hg + CO2 + 2 HCI
Proprietățile reducătoare ale acidului formic se explică prin faptul că acesta este, în același timp, un acid și o oxialdehidă, așa cum se poate observa din formula sa.
2. când este încălzit cu H2SO4 concentrat se descompune pentru a forma apă și CO:
3. sărurile de metale alcaline se descompun când sunt condensate pentru a forma săruri de acid oxalic (oxalați):
2 HCOONa® H2 + NaOOC-COONa
Acid acetic. Este utilizat pe scară largă pentru prepararea esterilor, anhidridei acetice, acetatului de vinil, precum și pentru producerea de coloranți, substanțe medicinale și aromate. De mare importanță practică sunt sărurile acidului acetic - sodiu, aluminiu, crom, fier, cupru, plumb etc. În industrie, acidul acetic este produs în mai multe moduri:
1. oxidarea alcanilor;
2. oxidarea etanolului;
3. hidratarea acetilenei și oxidarea acetaldehidei rezultate;
4. Fermentarea cu acid acetic a soluțiilor care conțin zahăr.
Trimiteți-le prietenilor: