Țesutul conjunctiv în total este de aproximativ 50% din greutatea corporală totală. Țesutul conjunctiv este țesutul țesutului subcutanat, tendoanelor, ligamentelor, cartilajului, precum și matricea organică a oaselor și dinților, intermediare intermediare fasiale. Țesutul conjunctiv din jurul vaselor de sânge, se conectează celulele tisulare individuale, umple spațiul dintre celulele așa numita substanță de bază (stroma intraorganic organe parenchimatoase, creier, neurogliei și t. D.).
Țesutul conjunctiv este alcătuit din trei elemente principale (vezi diagrama).
1. Celulele țesutului conjunctiv (fibroblaste, condrocite). În comparație cu alte țesuturi, ele sunt puține. Prin urmare, materialul interstițial ocupă mai mult spațiu decât elementele celulare.
2. Colagenul, fibrele elastice și reticulare situate în mediul interstițial.
3. Substanța intermediară (substanța de bază), care înconjoară celulele și fibrele țesutului conjunctiv.
Există trei componente majore moleculare ale tesutului conjunctiv: doua proteine fibrilare - colagen și elastină, care sunt prezente în proporții variabile în majoritatea tipurilor de țesut și proteoglicani conjunctiv - molecule care sunt proteine legate covalent de polizaharide.
Colagenul este principala proteină a fibrelor de colagen. Fibrele de colagen sunt formațiuni morfologice care conțin colagen și alte componente chimice pe lângă proteine.
Colagenul are o compoziție specifică de aminoacizi: aproximativ 1/3 (33%) din resturile de aminoacizi este în glicină. Cantitatea de prolină din colagen este, de asemenea, semnificativ mai mare decât în cazul altor proteine. În cele din urmă, în colagen există doi aminoacizi care sunt extrem de rare în alte proteine, și anume hidroxiprolina și hidroxizina:
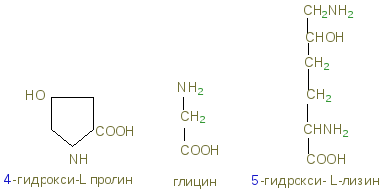
prolină și hidroxiprolină reprezintă o parte din resturile de aminoacizi și aproximativ 1% hidroxilizină. În colagen, o anumită secvență de aminoacizi: aproape fiecare al treilea reziduu este glicină; situl glicină-prolină-hidroxiprolină se repetă adesea.
Principala unitate structurală de colagen este tropocollagenul, a cărui masă moleculară este de aproximativ 285.000 D. Tropocollagenul constă din trei lanțuri de polipeptide de aceeași mărime. Fiecare lanț polipeptidic al tropocollagenului conține aproximativ 1000 de resturi de aminoacizi, adică unitatea structurală de bază a colagenului - tropocollagen este mare, în special, este de peste 10 ori mai mare decât cea a chymotrypsinei.
Moleculă tropocollagen are forma unei tije. Fiecare dintre cele trei lanțuri polipeptidice are forma unei α-helix înfășurată la stânga. În plus, aceste trei lanțuri spiralate sunt răsucite unul față de celălalt, formând un fir strâns, răsucite în dreapta. Cele trei lanțuri polipeptidice legate între ele prin legături de hidrogen care apar în principal datorită grupului peptidnyhNH hidrogen și oxigen peptidului glicină C = O grupe ale resturilor de aminoacizi în celelalte lanțuri.
Colagenul este sintetizat de celulele din aminoacizii liberi. Cu toate acestea, hidroxiprolina și hidroxilizina nu sunt incluse în lanțul polipeptidic al colagenului în timpul biosintezei colagenului. Acești aminoacizi sunt formate cu enzime și prolingidroksilazy lizingidroksilazy respectiv precum și implicând acid ascorbic după lizinei și prolină într-un lanț polipeptidic. Aceste enzime conțin în centrul activ un atom de fier în feroform (starea redusă a atomului de fier Fe2 +). Acidul ascorbic acționează ca agent reducător, reținând atomul de fier în feroform. Reziduurile de hidroxiprolină dau structurii o stabilitate suplimentară datorită formării unui număr mare de legături de hidrogen intramoleculare (pentru aceasta se folosesc moleculele de apă din jur). În absența acidului ascorbic este colagen non hidroxilat și, prin urmare, nu pot forma o structură normală a fibrelor de colagen, rezultând o leziune a pielii și vas fragilitate, distinct în scorbut.
Tropocollagenul, așa cum este reprezentat în schemă, este sintetizat de fibroblaste sub formă de procolagen.
Lanțurile polipeptidice ale procolagenului au situsuri peptidice suplimentare la capetele lanțurilor polipeptidice (Figura: Conversia procolagenului la tropocollagen). Aceste situsuri peptidice se numesc peptide N-terminale și C-terminale.
Schema de formare a fibrei de colagen mature
Articole similare
Trimiteți-le prietenilor: