Problema 1. Calculați concentrația ionilor de hidrogen în soluția HCN (Sm = 10 -3 M), dacă = 4.2 ∙ 10 -3.
Soluție: Disocierea acidului cianic se realizează conform ecuației HCN ↔ H + + CN-; concentrațiile ionilor de [H +] și [CN -] din soluție sunt egale unul cu celălalt (deoarece H + CN - = 1: 1, unde
sunt coeficienți stoichiometrici; [H +] = [CN-] = Cm. mol / l; Apoi [H +] = [CN -] = 4,2 ∙ 10 -3 ∙ 10 -3 = 4,2 ∙ 10 -7 mol / l.
Problema 2. Se calculează concentrația de ioni de hidrogen și ioni de hidroxid în rstvore NH4OH, se vedea = concentrația 0,01 M, în cazul în care Kd = 1,810 -5.
Soluție: Hidroxidul de amoniu se disociază după cum urmează:
NH4OH ↔ NH4 + + OH -. constanta de disociere are forma
concentrațiile de ioni de amoniu [NH4 +] și hidroxid [OH-] sunt aceleași ( (NH4 +): (OH -) = 1: 1)
[NH4 +] = [OH-] = x mol / l. Apoi, expresia pentru Kq ia forma
1,8⋅10 -5 = х2 / 0,01-х. Presupunând că x <<См. решаем уравнение
1,8 × 10 -5 = x 2 / 0,01, în raport cu x. x =
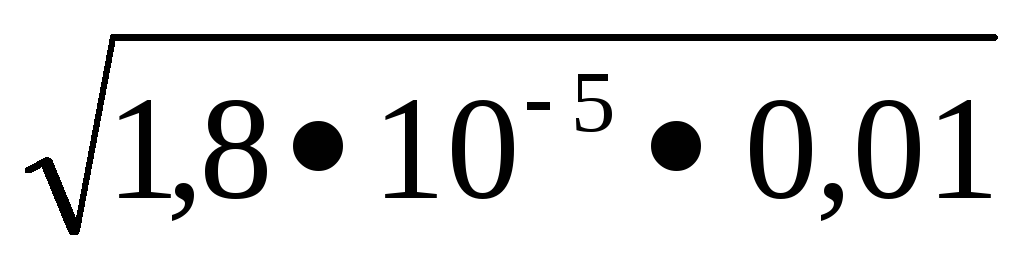
Concentrațiile de ioni de hidrogen și hidroxid sunt conectate prin produsul ionic al apei Kw = [H +] [OH -] = 10 -14. exprimăm concentrația de ioni de hidrogen [H +] = Kw / [OH -] și calculăm valoarea lui:
[H +] = 1, 10 -14 / 4, 2, 10 -4 = 2,3, 10 -11 mol / l.
Problema 3. Determinați pH-ul soluției de HCl ( = 1), dacă Sm = 2 ∙ 10 -3 M
Soluție: Disocierea acidului clorhidric se realizează conform ecuației
HCI H + + Cl -. concentrația ionilor de hidrogen [H +] = Cm = 1 ∙ 2 ∙ 10 -3 = = 2 ∙ 10 -3 mol / l. PH-ul de hidrogen este - - log [H +] = - lg2 ∙ 10 -3 = 2.7.
Problema 4. Determinați concentrația molară a hidroxidului de amoniu, dacă pH = 11, și Kd = 1,8 ∙ 10 -5.
Soluție: Concentrația ionilor de hidrogen [H +] = 10 - pH = 10-11 mol / l. Din produsul ionic al apei, determinăm concentrația de [OH -] = Kw / [H +] = 10 -14 / 10-11 = 10-3 mol / l. Hidroxidul de amoniu este o bază slabă și se caracterizează prin ecuația reacției de disociere
NH4OH ↔ NH4 + + OH -. Expresia pentru constanta de disociere
Produs de solubilitate
Substanțele, în funcție de natura lor, au o solubilitate diferită în apă, care variază de la fracțiuni de miligrame la sute de grame pe litru. Electroliții solubili dificili formează soluții saturate de concentrații foarte mici, deci putem presupune că gradul de disociere ajunge la unitate. Astfel, o soluție saturată de electrolit slab solubil este un sistem care constă într-o soluție adecvată care este în echilibru cu sedimentul substanței dizolvate. In conditii externe constante, viteza de dizolvare a precipitatului este egala cu rata de cristalizare: Kn Am ↔ n K + m + m A - n (1)
Pentru a descrie acest proces de echilibru eterogen, se folosește o constantă de echilibru numită produsul de solubilitate OL = [K + m] n [A - n] m. unde [K + m] și [A-n] sunt concentrațiile de ioni în soluția saturată (mol / l). De exemplu:
AgCl = Ag + + Cl-. OL = [Ag +] [CI-]; aici n = m = 1.
PbI2 = Pb2 + + 2I -. PR = [Pb2 +] [I -] 2; aici n = 1, m = 2.
PR depinde de natura substanței și a temperaturii dizolvate. OL este o valoare tabelară. Cunoscând PR, este posibil să se calculeze concentrația soluției saturate a substanței și, de asemenea, să se estimeze solubilitatea acesteia în g pe 100 ml de apă (valoarea indicată în literatura de specialitate) și să se determine posibilitatea de precipitare a substanței în sediment.
Pentru ecuația (1) saturată Relația soluție rastovrimogo substanță tare cu valoarea PR este determinată prin următoarea ecuație (A se vedea mol / l.):

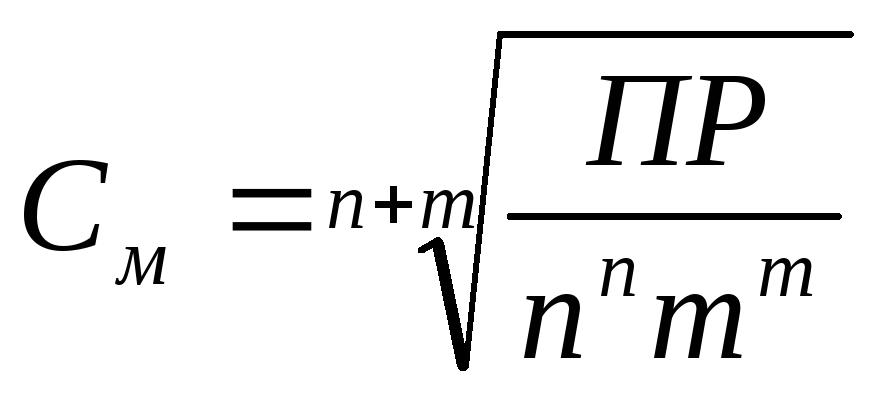
unde n și m sunt coeficienți stoichiometrici în yp. 1.
Problema 5. Concentrația soluției saturate (cm) Mg (OH) 2 este 1,1 • 10-4 mol / l. Scrieți expresia pentru PR și calculați valoarea sa.
Soluție: În rastvoreMg saturată (OH) 2 de echilibru se stabilește între precipitatul și rastvoromMg (OH) 2 ↔Mg 2+ + 2OH -. pentru care expresia PR are forma OL = [Mg2 +] [OH -] 2. Cunoscând concentrația de ioni, se poate găsi valoarea numerică. Luând în considerare disocierea completă
Mg (OH) 2, concentrația soluției sale saturate este Sm = [Mg2 +] = 1,1 × 10-4 mol / l și [OH -] = 2 [Mg2+] = 2,2 × 10-4 mol / l. Prin urmare, PR = [Mg2 +] [OH -] 2 = 1.1. 10 -4 (2,2 10 -4) 2 = 5,3. 10-12.
Problema 6. Se calculează concentrația de soluție saturată și PR de cromat de argint, dacă 0,011 g de sare se dizolvă în 0,5 l de apă.
Soluție: Pentru a determina concentrația molară a soluției saturate Ag2 CrO4, se utilizează formula CM =
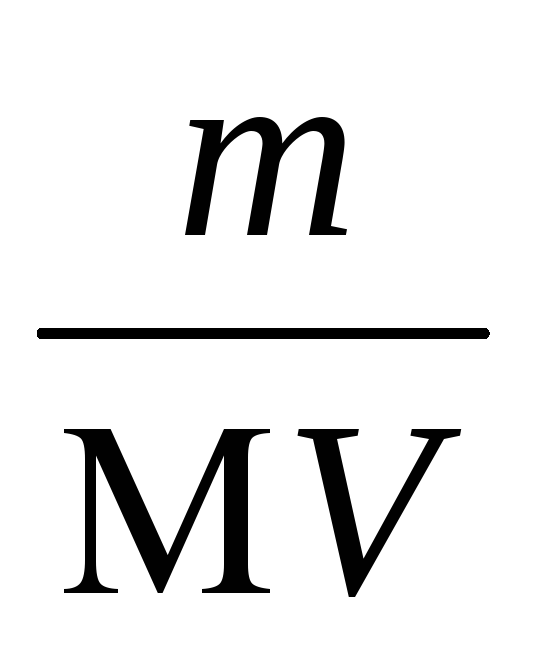
Astfel, PR = (1,896 × 10-4) 2 (9,48 × 10 -5) = 3,4 × 10-12.
Problema 7. Este posibil să se prepare soluții de sare de CaCO3 cu concentrații de CaCO3 C1 = 10-2 M și C2 = 10-6 M. Dacă PRCaCO3 = 3.8⋅10 -9.
Soluție: Cunoașterea valorii PR, puteți calcula concentrația
soluție sare saturată și, comparând-o cu soluția propusă
concentrare, să tragem o concluzie cu privire la posibilitatea sau imposibilitatea de a pregăti soluții. Dizolvarea carbonatului de calciu se realizează conform schemei CaCO3 ↔Ca2 + + CO3 2- În această ecuație, n = m = 1, atunci
С1> См - este imposibil să se pregătească o soluție, deoarece precipitatul va cădea;
C2 <См – раствор приготовить можно.
Reacții de schimb ionic
Reacțiile schimbului de ioni sunt caracteristice pentru soluțiile de electroliți. O condiție esențială pentru apariția unor astfel de reacții este practic la sfârșit, îndepărtarea anumitor ioni din soluție datorită:
1) precipitarea formării
FeSO4 + 2 NaOH Fe (OH) 2 + Na2S04 - Ecuația moleculară (MU)
Fe2 + + SO4 2 + 2Na + + 2OH - Fe (OH) 2 + 2Na + + SO4 2-ecuația moleculară ionică (IMU).
Fe 2+ + 2OH - Fe (OH) 2 (PR Fe (OH) 2 = 4,8 × 10 -16) - ecuația moleculară ionică scurtă de formare a precipitatului;
2) evoluția gazului
formarea unui compus volatil.
3) formarea de electroliți slabi
a) substanțe simple:
2K + + 2CN - + 2H + + SO4 2 - 2HCN + 2K + + SO4 2- (IMU)
CN - + H + HCN (KdHCN = 7,8 • 10 - 10) ur-molecular molecular ionic de formare electrolitică slabă a HCN.
b) compuși complexi:
Zn 2+ + 4NH3 [Zn (NH3) 4] 2+ - o ecuație moleculară ionică scurtă pentru formarea unui cation complex.
Există procese în care electroliții slabi sau compușii slab solubili sunt printre materiile prime și produsele de reacție. Echilibrul în acest caz se îndreaptă spre formarea substanțelor care au cea mai mică constantă de disociere sau spre formarea unei substanțe mai puțin solubile:
Echilibrul este mutat spre formarea moleculelor de apă.
B) AgCl + NaI AgIles + NaCI (MU)
AgClÎs + Na + + I - AgIys + Na + + Cl -
AgClÎns + I - AgImes + Cl - (IMU)
Echilibrul este mutat spre formarea precipitării Agl.
C) Pot exista procese în ecuațiile de care există un compus slab solubil și un electrolit slab
MnSins + 2H + + 2Cl - Mn2 + + 2Cl - + H2S
MnSs + 2 H + Mn 2+ + H2 Sicro (IMU)
PRMnS = 2,5, 10 -10; [S -2] =
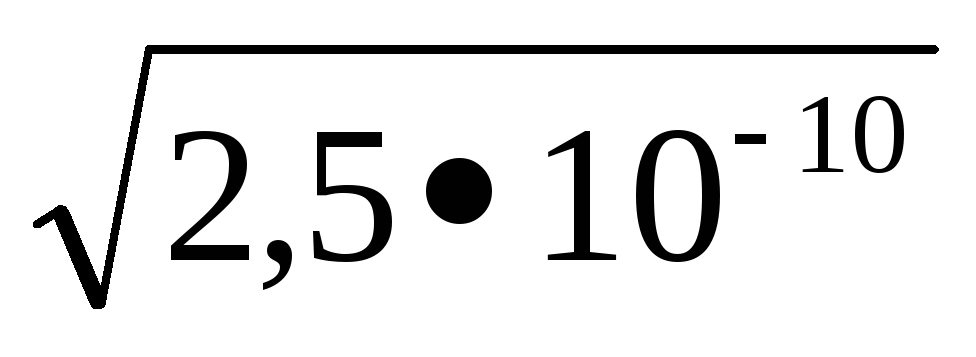
KdH2S = K1; K2 = 6; 10 -22; [S2] =
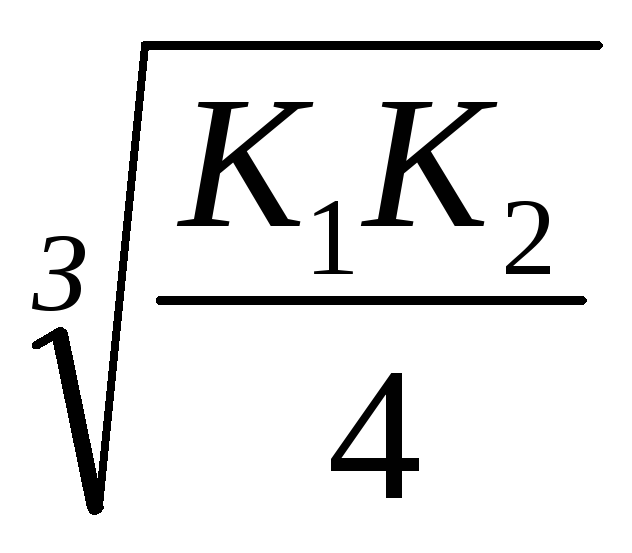
Legarea ionilor de S2 la moleculele H2 se desfășoară mai mult decât în MnS, deci reacția se desfășoară în direcția înainte, spre formarea H2S
Hidroliza este rezultatul interacțiunii polarizării ionilor de sare cu carapacea lor hidratată. Hidroliza este o reacție de schimb într-o soluție între moleculele de apă și ionii sării. Ca rezultat al hidrolizei, datorită formării unui electrolit slab (acid slab sau bază slabă), echilibrul ionic este schimbat O⇄N + H2 + OH - datorită legării H + sau OH - și pH-ul mediului este schimbat. Hidrolizele suferă săruri care conțin ioni slabi de acid slab sau slab. Sărurile formate de acidul puternic și ionii de bază tari nu sunt supuși hidrolizei (NaCI, Na2SO4). Produsele de hidroliză pot fi electroliți slabi, substanțe slab dispersabile, greu solubile și volatile. Hidroliza este o reacție treptată, în cazul unui ion multiplu încărcat, numărul de etape este egal cu sarcina sa. Hidroliza la cation este afectată de săruri formate de anioni puternici ai acidului și cationi ai unei baze slabe. De exemplu, bazele slabe includ hidroxizii metalelor p și d (Kd 10 -4), precum și hidroxidul de amoniu.
Clorura de zinc este o sare formată din baza slabă a Zn (OH) 2 și un acid puternic de HCI. Cationul de zinc are o încărcătură de 2+, astfel încât hidroliza va avea loc în două etape:
Zn2 + + HOH ↔ ZnOH + + H + I pas
ZnOH + + HOH2 + Zn (OH) 2 + H + ll
Ca urmare a acestei interacțiuni, apare un exces de ioni de H + [[H +]> [OH -]). soluția este acidificată (pH<7).
Hidroliza prin anion. Acest tip de hidroliză este caracteristic sărurilor formate din anionii slabi ai acidului (Kd 10-3) și cationii bazei puternice (Kd> 10-3). Luați în considerare carbonat de potasiu hidroliză - sare formată slab carbonic kislotoyH2 CO3 (I = 4,5 KD 10 -7.) Și osnovaniemKOH puternic, anion carboxi având o sarcină (2). Hidroliza are loc în două etape:
În acest caz, ionii OH - ([H +] [OH -] sunt eliberați - soluția devine alcalină (pH> 7).
Hidroliza ireversibilă. Sărurile formate dintr-o bază slabă și un acid slab sunt hidrolizate de cation și de anioni. Rezultatul hidrolizei va depinde de valoarea Kd a bazei și a acidului. Luați în considerare hidroliza fluorurii de amoniu - o sare formată de un slab
baza de NH4OH (Kd = 1,8.10-5) și acidul slab HF (Kd = 6,8.10-4):
Articole similare
Trimiteți-le prietenilor: