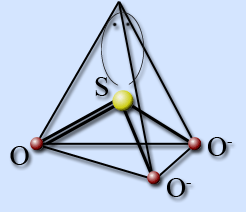
Ionul sulfit are structura unei piramide trigonale cu un atom de sulf la vârf. Hibridizarea sulfului sp 3. Există o pereche de electroni împărțită pe atomul de sulf.
Ionul de hidrosulfit există ca două forme izomerice. În izomerul I, atomul de hidrogen este legat la atomul de sulf și la izomerul II la atomul de oxigen. La o temperatură de 20 ° C, proporția celei de-a doua forme este de 20%.
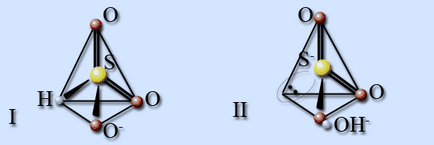
Proprietăți chimice ale sulfitilor
Sulfitidele solubile se hidrolizează puternic:
Acidul sulfuric și sărurile sale prezintă proprietăți de reducere pronunțate:
Soluțiile apoase de sulfuri de metale alcaline sunt oxidate în aer:
Sulfitidele metalice alcaline solide sub încălzire puternică sunt disproporționate:
și sărurile metalelor alcalino-pământoase se descompun prin încălzire în vid la oxizi:
1.12. Compușii de sulf (VI)
Gradul de oxidare a +6 pentru sulf este destul de stabil și se manifestă în compuși cu mai multe elemente electronegative: în hexafluorură SF6. oxo și dioxo-halogenuri, oxid și anionii lor corespunzători. Vom cunoaște proprietățile trioxidului de sulf și ale acidului sulfuric.
1.12.1. Oxidul de sulf (VI) Structura moleculei este so3
În faza gazoasă, trioxidul de sulf există ca molecule monomerice. Atomul de sulf este în stare de hibridizare sp 2, forma moleculei este triunghiul drept. Lungimea legăturii S-O este de 0,142 nm, unghiul de valență este de 120 °. Multiplicitatea legăturii S-O este 2.
Anhidrida sulfurică solidă formează mai multe modificări polimorfe. În gheață ca γ-SO3, tetraedrele SO4 sunt conectate prin vârfuri comune la trimerii ciclici S3O9. care amintește de silicații ciclici.
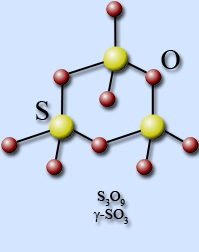
În timpul topirii, se formează un lichid constând în principal din trimer.
Proprietățile fizice ale oxidului de sulf (VI)
În condiții normale, trioxidul de sulf este un lichid incolor.
Proprietățile chimice ale oxidului de sulf (VI)
Anhidritul sulfuric este instabil din punct de vedere termic. Descompunerea lui începe la 450 ° C, iar la 1200 ° C nu există molecule de SO3 complet în faza gazoasă:
Reacționează violent cu apă, eliberând o mulțime de căldură. Trioxidul de sulf gazos este slab absorbit de apă, deoarece se formează ceață:
Acesta arată proprietățile unui tipic oxid de acid:
Anhidritul sulfurat este unul dintre cei mai reactivi compuși. Ea prezintă doar proprietăți oxidante, de exemplu:
Prepararea oxidului de sulf (VI)
În industrie este produs pe o scară largă pentru a produce acid sulfuric:
În laborator, unele dintre sulfați sunt descompuse termic:
1.12.2. Acid sulfuric
Când se dizolvă trioxidul de sulf în apă, se formează acid sulfuric puternic, unul dintre cele mai importante produse de producție chimică.
Articole similare
Trimiteți-le prietenilor: