Acid-bază proprietăți ale alcoolilor
în soluția apoasă, aciditatea alcoolilor se modifică după cum urmează:
Formal, această secvență se schimbă alcooli aciditatea ar fi de așteptat pe baza creșterii efectului radicalilor inducerii în acest rând, care, la rândul său, ar trebui să conducă la o creștere a densității de electroni pe atomul de oxigen al alcoolului. Ca rezultat, aciditatea alcoolilor ar trebui redusă. Cu toate acestea, se pare mai probabil mai puțin puternic formarea unei legături de hidrogen la această lenii-direcție, datorită creșterii obstacolelor spațiale creșterea volumului radicalii hidrocarbonați din seria:
Formarea unei legături de hidrogen precede întotdeauna transferul unui proton în solvenți care conțin hidroxil. Tabelul 2 prezintă aciditatea celor mai simple alcooli, care confirmă această poziție.
Aciditatea alcoolilor
Din aceste date rezultă că echilibrul în sistemul alcool-alcalin este întotdeauna schimbat spre alcool și nu pentru alcoolat:
Pentru conversia cantitativă a alcoolului într-un alcoolat, este necesară utilizarea unor baze mult mai puternice, cum ar fi hidruri sau amide ale metalelor alcaline sau alcalino-pământoase sau reactivi Grignard.
În ceea ce privește acizii minerali puternici, alcoolii prezintă proprietățile bazelor și formează săruri de alcoxoniu:
acid de bază "bază"
Această reacție este prima etapă în reacțiile de alcooli care apar într-un mediu acid, adică când gruparea hidroxil este înlocuită cu halogen, deshidratarea alcoolilor și formarea de eteri.
Înlocuirea grupării hidroxil pentru halogen. Prepararea halogenurilor alchilice
Există multe modalități de a înlocui gruparea hidroxil a unui alcool cu halogen. Aceste metode de substituție a grupării hidroxil cu un atom de halogen, bazate pe reacția alcoolilor cu halogenuri de hidrogen, și halogenuri și oxohalides cu fosfor fosfor și sulf.
Prepararea halogenurilor alchilice din alcool și acizi halogenați
ROH + HHal → RHal + H20
Reactivitatea halogenurilor de hidrogen scade în seria HI> HBr> HCl >> HF. Rata reacției de substituție crește în seria primară> secundară> alcool terțiar. Pentru prepararea alchilgalogenilor terțiari este de obicei suficientă tratarea alcoolului terțiar cu o soluție apoasă concentrată de acid clorhidric, bromhidric sau iodhidric la temperatura camerei. Pentru prepararea bromurii de alchil primare și secundare și a iodurilor alchilice, este de obicei necesar să se încălzească un amestec de alcool cu acid bromhidric concentrat sau acid iodhidric. În loc de soluții apoase concentrate de HBr și HI, se pot folosi bromuri și ioduri de sodiu și potasiu și acid sulfuric concentrat sau acid fosforic. Randamentele halogenurilor alchilice prin această metodă sunt de obicei 75-90%. Câteva exemple sunt prezentate mai jos.
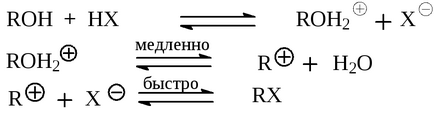
Prima etapă a reacției este formarea alcoolului dintr-un ion de alcoxoniu
Următoarea etapă pentru alcoolii primari și unele secundare este reacția de substituție a apei SN2 în cationul de alcoxoniu pentru halogen:
pentru producerea de cloruri alchilice, interacțiunea alcoolilor primari cu acid clorhidric utilizează un catalizator electrofilic-clorură de zinc anhidră. Un amestec de acid clorhidric și clorură de zinc se numește reactivul Lucas. În absența unui catalizator, reacția are loc într-un ritm mult mai lent.
Alcoolii terțiari și unele secundare interacționează cu hidrogenul halohidrogen prin mecanismul SN1 cu formarea unei carbococcite intermediare, care apoi formează produsul final cu anionul de halogen.
Trimiteți-le prietenilor: