Atomi și molecule în fizică
Un atom este cea mai mică particulă a unui element chimic dat. Toți atomii existenți în natură sunt reprezentați în sistemul periodic al elementelor lui Mendeleev.
Atomii sunt conectați la o moleculă prin legături chimice bazate pe interacțiunea electrică. Numărul atomilor dintr-o moleculă poate fi diferit. O moleculă poate consta din una, două, trei, sau chiar câteva sute de atomi.
O moleculă este cea mai mică particulă a unei substanțe date care are proprietățile sale chimice.
Teoria moleculare-cinetică este studiul structurii și proprietăților materiei pe baza ideilor despre existența atomilor și a moleculelor.
Fondatorul teoriei moleculare-cinetice este M.V. Lomonosov (1711-1765), care și-a formulat principalele dispoziții și le-a aplicat explicării diferitelor fenomene termice.
Principalele prevederi ale teoriei moleculare-cinetice
Principalele prevederi ale ICB:
- toate corpurile din natură constau din cele mai mici particule (atomi și molecule);
- particulele sunt într-o mișcare continuă haotic, care se numește termică;
- particulele interacționează între ele: între particule acționează forțe atractive și respingătoare, care depind de distanța dintre particule.
Teoria moleculare-cinetică este confirmată de multe fenomene.
Amestecarea diferitelor lichide, dizolvarea substanțelor solide în lichide se explică prin amestecul de molecule de diferite tipuri. Volumul amestecului poate diferi de volumul total al componentelor incluse în acesta. care indică dimensiunile diferite ale compușilor moleculari.
Difuzia este un fenomen al pătrunderii a două sau mai multe substanțe învecinate.
Cea mai intensă difuzie are loc în gaze. Răspândirea mirosurilor se datorează difuziei. Difuzia indică faptul că moleculele se află într-o mișcare constantă haotică. De asemenea, fenomenul de difuzie indică faptul că există lacune între molecule, adică substanța este discretă.
Miscarea Brownian este mișcarea termică a particulelor microscopice minute suspendate într-un lichid sau gaz.
Acest fenomen a fost observat pentru prima oara de botanistul englez Robert Brown, în 1827. Privind prin polenul microscop suspendat în apă, el a văzut că fiecare particulă de polen face mișcare aleatoare rapidă, se deplasează cu o oarecare distanță. Ca urmare a mișcărilor individuale, fiecare particulă de polen sa mutat de-a lungul unei căi zig-zag (fig.1, a).
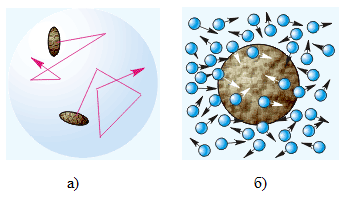
Fig.1. Miscarea Brownian: a) traiectoria mișcării particulelor individuale suspendate într-un lichid; b) transferul impulsului de către moleculele unui fluid către o particulă suspendată.
Investigațiile ulterioare ale mișcării Brownian în diferite lichide și cu diferite particule solide au arătat că această mișcare devine mai intensă, cu atât dimensiunile particulelor sunt mai mici și cu cât temperatura experimentului este mai mare. Această mișcare nu se oprește niciodată și nu depinde de cauze externe.
R. Brown nu a putut explica fenomenul observat. Teoria mișcării browniene a fost construită de A. Einstein în 1905 și a primit confirmarea experimentală în experimentele fizicianului francez J. Perrin (1900-1911).
Moleculele de lichid care sunt în mișcare constantă haotică atunci când se ciocnesc cu o particulă suspendată îi transmit un impuls (fig.1, b). În cazul unei particule de dimensiuni mari, numărul moleculelor care intră pe ea din toate părțile este mare, impactul lor la fiecare moment este compensat, iar particula rămâne practic imobila. Dacă dimensiunea particulelor este foarte mică, atunci impactul moleculelor nu este compensat - pe de o parte, mai multe molecule se pot lovi decât pe cealaltă, astfel încât particula se va mișca. Această mișcare este sub influența impulsurilor aleatoare ale moleculelor care fac particule Browniene. Deși particulele Browniene sunt în masă de miliarde de ori mai mari decât masa moleculelor individuale și se mișcă cu viteze foarte scăzute (în comparație cu vitezele moleculare), mișcarea lor poate fi observată încă într-un microscop.
Exemple de rezolvare a problemelor
Cum poți să explici că, după un timp după deschidere într-o cameră cu o sticlă de parfum, mirosul este simțit în întreaga cameră?
Când flaconul este deschis, parfumul începe să se evapore. Moleculele de băuturi spirtoase penetrează între moleculele de aer ca urmare a difuziei și umple întregul spațiu al camerei.
Dacă creta zdrobită este amestecată în apă, atunci particulele de cretă se vor agăța mult timp în coloana de apă și nu se vor depune pe fund. Acest fenomen se explică prin faptul că:
1) apa le împinge după legea lui Arhimede;
2) particulele de cretă fac o mișcare Browniană în apă;
3) Pământul nu atrage particule atât de mici;
4) temperatura particulelor de cretă este mai mare decât temperatura apei.
Particulele de cretă zdrobită sunt suficient de mici, astfel încât acțiunea exercitată asupra lor prin mișcarea termică a moleculelor de apă este semnificativă. În consecință, particulele de cretă fac o mișcare browniană, astfel încât să nu se așeze mult timp până la fund. Răspunsul corect este 2.
De ce intensitatea mișcării Brownian scade odată cu scăderea temperaturii lichidului?
Cu cât temperatura este mai mică, cu atât moleculele (sau gazul) în care este localizată particula Brownian sunt mai lentă, cu atât mai puțin intensitatea transferă impulsul și energia particulei în coliziune.
Articole similare
Trimiteți-le prietenilor: