INTERMEDIUL POTENȚIAL JUMPS.
diferența de electricitate. potențiale la limita interfeței electrod-electrolit, datorită spațiilor. separarea acuzațiilor și determinată de activitatea de transfer prin această limită a unei singure taxe imaginare. La transferul dintr-un punct C infinit îndepărtat în vid, situat într-un punct A, localizat în interiorul gâtului fazei și roiul (ex. Metal sau electrolit r-ra), M. p. n. numit. potențialul intern al fazei a și este notat cu j a (figura 1). Este condiționată de liberă. electrostatic. încărcarea fazei a însăși, care creează un salt în potențialul Y a. numit. potențialul de fază externă și spațiile. separarea încărcăturilor legate la limita vidului și a fazei a, în urma căreia apare o supernova a potențialului Xa. Prin urmare, j a = Y a + X a.
Y un potențial determinat de către unitatea de transport de muncă sarcina unui punct imaginar infinit îndepărtat C în vid până la un punct A „paradisul este, de asemenea, în vid, dar aproape și fază. Deci, dacă faza a-sferă a razei R și este liberă. încărcarea Q, în conformitate cu legile electrostaticelor Ya = Q / 4pe0 R,> unde e0 = 8,854. 10-12 F / m-electric. constanta (permeabilitate vid vid dielectric). Punctul A 'este ales la o distanță atât de mică, deși este în faza a, astfel încât Q / 4pe0 (R + x) Q / 4pe0 R,> x<
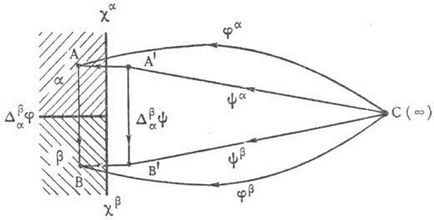
Fig. 1. potențialul de interfazare sare în contactul fazelor a și b.
Potențialul X a este determinat de lucrarea de transfer a unei singure încărcări imaginare de la punctul A 'la punctul A în faza a. Dacă a este un metal, Xa apare deoarece gazul de electroni este în afara domeniului cristalin. metalice și astfel creează spații. separarea taxelor; în timp ce X a> 0. Dacă a-p-p al electrolitului, mecanismul apariției lui X a se presupune a fi după cum urmează. Deoarece forțele care acționează asupra primului strat al moleculelor moleculare din partea de vid (sau de aer) și din partea p-ra sunt în esență diferite, distribuția particulelor particulare în apropierea situsului p-ra diferă de starea lor haotică. distribuție în volumul p-ra. În acel moment există întotdeauna unele preferințe. orientarea moleculelor moleculare și, dacă sunt polare, adică au un moment dipol, orientarea lor poate duce la spații. separarea sarcinilor și apariția unei diferențe de potențial. Pe de altă parte, același efect m. o consecință a solvației inegale a anionilor și cationilor în p-re și disulfid. distanța dintre centrele lor de încărcare și interfața de fază din stratul de suprafață al p-ra.
Dacă fazele a și p sunt în contact, iar punctele B și B 'sunt amplasate respectiv. în faza b în vid, la o distanță x 10 -6 m de dressing-sti (Fig. 1), altele decât cele potențial b fază descrisă (j b. Y b și X b) există, de asemenea, diferența de potențial între punctele A și B, numit. se numește potențialul galvanic (numit Da b j) și punctele A 'și B'. volt potențial (Da b Y). Potențialul galvanic este determinat de transferul unei singure încărcări imaginare de la punctul A la punctul B, potențialul de tensiune de la A 'la B'. Deoarece operațiunea de transfer de sarcină este independentă de calea de transport și potențialele volt Gal-vani- poate fi scrisă ca diferența dintre potențialele respective interne sau externe: Da b j = j b - j o; Da b Y = Y b - Y a. În plus, așa cum se poate vedea din fig. 1, Da b Y = Xa + Da b j - X b.
Ca în orice experiment nu izolat taxe imaginare transfer de taxe prin intermediul interfeței și particulele încărcate reale (electroni, ioni) implicate este întotdeauna măsurată prin transportul de lucru al acestor particule este determinată de diferența dintre electrochimic lor. potențiale în ambele faze. Prin definiție, potențialul electrochimic al particulei i în faza a mi a = mi a + j a, unde mi este -him. potențialul acestei particule în faza a, z și -e este numărul de sarcină, F este faza constantă. Transferul a 1 mol de particule i de la a la b este egal cu: mi b mi mi a = (mi b mi mi a) + (j b j j a). Este imposibil să împărțim experimental această valoare în două componente - chimice (mi b mi mi a) și electrice (j b j j a) - imposibile. Rezultă că electric. diferența potențială dintre două puncte m. măsurată numai cu condiția ca aceste puncte sunt aceleași faze de compoziție, atunci când mi b H a = 0. km potențialele De aceea, interne și de suprafață, și potențialele galvanice la interfața dintre cele două faze ale diferitelor compoziții nu m. b. măsurat; potențialele externe și volta-potențialele sunt accesibile determinării experimentale.
În electrochimie convențională. experimentele care utilizează un voltmetru sau un potențiometru determină întotdeauna diferența de potențial la capetele unui circuit corect deschis, adică un circuit care se termină cu conductori din același metal. De obicei, acest lucru se realizează prin simpla conectare a firelor de cupru la electrozii Ml și M2 (figura 2, a). Un astfel de circuit are patru potențiale galvanice: D M1 Cu j, D p-p M1 j, D M2 p-p j și D Cu M2 j. Cu toate acestea, se poate arăta că acest lanț este echivalent cu lanțul arătat în Fig. 2, care conține doar trei potențiale galvanice: D M1 M2 j, D p-p M1 j și D M2 p-p j. Într-adevăr, includerea unui conductor din metal M2 între firul de cupru și metalul Ml (Figura 2.6) nu modifică diferența de potențial la capetele lanțului. Prin urmare, lanțurile din Fig. 2, a, 2, b sunt echivalente. Dar lanțul din Fig. 2b este simultan echivalent cu lanțurile din Fig. 2, c, deoarece acesta diferă de acesta prin două potențiale galvanice D M2 Cu j, care se compensează reciproc. În consecință, lanțurile prezentate în Fig. 2, a și 2, c.
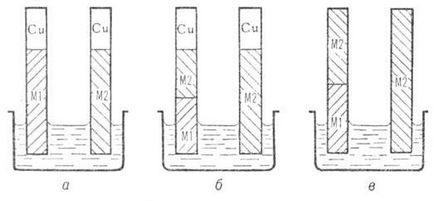
Fig. 2. Electrochimie echivalentă deschisă corect. lanț.
Deși abs. Valorile lui X a și D b a j nu pot fi măsurate, este posibil să se determine din experiența schimbările lor. Deci, dacă în sistem (Fig. Starea metalului Ml este lăsată neschimbată, iar M2 este schimbată prin polarizare de la exterior. sursă prin imersie în p-r al treilea auxiliar. electrodul, modificarea diferenței de potențial dintre cei doi primi electrozi va fi egală cu modificarea potențialului galvanic D M2 p-p j.
Potențialul de suprafață trebuie distins de lucrarea accesibilă pentru măsurarea funcției de lucru W a i a particulei i, adică lucrarea de transfer al acesteia de la faza a la punctul A ', amplasat într-un vid la o distanță de cel puțin interfața dintre faze. Pentru 1 mol de particule, W a => m a i> zi F> X a. Dacă compoziția volumului fazei a nu se modifică și, prin urmare, m a i => const, iar potențialul de suprafață al acestei faze variază, de exemplu, ca urmare a adsorbției k. in-va, atunci variația lui X a este în mod unic legată de variația W a i prin formula dX a = d dW a i / zi F>. Acest fișier este baza experimentului. Definiția dX a.
Pentru a evalua abs. valorile lui X a sunt modelate. Aceasta stabilește faza de model de delimitare vid și distribuția particulelor încărcate la această limită este calculată X o (sau un set de volum de fază de model și se calculează la baza mai) și folosind valorile obținute experimental W ai calculat X o cu formula X a = - (mai + W ai) / zi F.> Dacă ambele metode oferă valori potrivite, estimarea poate fi considerată suficient de fiabilă.
Pentru calculul modelului potențialului galvanic, folosiți următoarea formulă: D b a j = D b a Y + X b X X a. în care acestea substituie potențialul volt găsit experimental și valorile Xb și Xa. obținută pe baza calculelor modelului.
REFERINȚE Damaskin, B. B. Petrii, OA, Introducere în cinetica electrochimică, ed. M. 1983. B. B. Damaskin.
Enciclopedii chimice. - Enciclopedia Sovietică. Ed. I. L. Knunyants. 1988.
Articole similare
Trimiteți-le prietenilor: