Scopul lecției este de a aplica cunoștințe teoretice pentru rezolvarea problemelor.
Pregătirea lecției: prelegeri nr. 22-25. Kasyanov V.A. Fizica-10 § 37, 39-44.
1. Câte molecule sunt conținute în dioxidul de carbon (CO2) cu o masă de 20 g?
2. Calculați presiunea produsă de moleculele de gaz pe pereții vasului dacă masa gazului este de 3 g, volumul este de 0,5 × 10-3 m 3 și viteza medie patrată a moleculelor este de 500 m / s.
3. Care este viteza medie pătrată a moleculelor de heliu la 27 ° C?
4. În timpul răcirii izochorice, presiunea gazului a scăzut cu un factor de 3. Care a fost temperatura inițială a gazului, dacă temperatura finală a ajuns la 27 ° C?
5. La o presiune de 10 5 Pa și o temperatură de 15 ° C, aerul are un volum de 2 litri. La ce presiune va fi aerul din această masă să ia un volum de 4 litri, dacă temperatura devine 20 ° C?
6. Care este energia internă a unui gaz monatomic ocupând un volum de 2,5 litri la o temperatură de 400 K, dacă concentrația moleculelor sale este de 10 20 cm -3?
7.
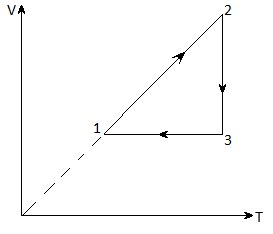
8. Graficul grafic al modificării stării unui gaz ideal în coordonatele V-T este dat în figură. Imaginați-vă acest proces pe graficele din coordonatele p-V și p-T.
9. Estimați diametrul atomului de carbon, știind valoarea densității diamantului, care este egală cu 3515 kg / m 3.
1. Găsiți numărul de atomi dintr-un obiect plumb cu o masă de 234 g.
2. Determinați la ce temperatură viteza medie patrată a moleculelor de oxigen este de 500 m / s.
3. Câte molecule sunt conținute în 2 m 3 de gaz la o presiune de 150 kPa și o temperatură de 27 ° C?
4. Într-un balon de 200 de litri, heliul este plasat la o presiune de 100 kPa la o temperatură de 17 ° C. După pomparea heliului, presiunea sa a crescut la 300 kPa, iar temperatura a crescut la 47 ° C. Cât de mult a crescut masa heliului?
5. În procesul de răcire cu izobar, volumul unui gaz ideal a scăzut cu un factor de 2. Care este temperatura finală a gazului dacă temperatura inițială este de 819 ° C? Masa gazului este constantă.
6. Gazul care se extinde izobaric prin adăugarea a 2 • 10 5 Pa, efectuează o sarcină de 200 J. Determinați volumul inițial al gazului dacă volumul său final este egal cu 2,5 litri.
7.
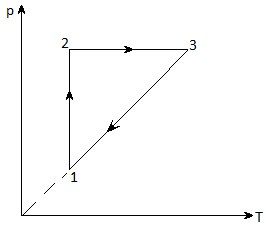
Într-un cilindru de 24 de litri, există un gaz care se extinde, la o presiune de 5 x 105 Pa. Care este volumul final al gazului, dacă la expansiunea sa se lucrează la 1,5 kJ?
8. Diagrama arată schimbarea stării unui gaz ideal în coordonatele p-T. Imaginați-vă acest proces în coordonatele p-V și V-T.
9. lac având o adâncime medie de 10 m și o suprafață de 20 km 2. sare cristal aruncat cântărind 0,01 g Numărul de molecule dovedit a sărurilor apei degetar într-un volum de 2 cm3 lingura de lac, în cazul în care se presupune că sarea dizolvat, distribuit neuniform pe întregul volum de apă?
1. Notați numele și scopul lecției.
2. Răspundeți la întrebările de control și obțineți admiterea la lucru.
3. Finalizați sarcinile.
1. Formulează principalele prevederi ale ILC.
2. Scrieți numărul Avogadro. Cum se calculează numărul de molecule dintr-o substanță?
3. Înregistrați dependența de temperatură a energiei cinetice medii. Care este constanta lui Boltzmann? Cum pot traduce valorii de temperatură exprimată în grade Celsius la Kelvin?
4. Notați ecuația de bază a MKT și constanta gazului universal.
5. Formulați legile gazului pentru o anumită masă de gaz.
Teoria moleculare-cinetică se referă la doctrina structurii și a proprietăților materiei pe baza ideii existenței atomilor și a moleculelor ca particule mai mici ale unei substanțe chimice.
În inima teoriei moleculare-cinetice se află trei propoziții de bază:
1. Orice substanță constă din cele mai mici particule - molecule și atomi. Acestea sunt situate în spațiu discret, adică la anumite distanțe unele față de altele.
2. Atomii sau moleculele de materie se află într-o stare de mișcare aleatorie. care nu încetează niciodată.
3. Atomii sau moleculele de materie interacționează între ele prin forțele de atracție și repulsie, care depind de distanțele dintre particule.
Un atom este cea mai mică particulă a unui element chimic dat, care își păstrează toate proprietățile chimice. Nu există atât de multe elemente chimice - toate sunt rezumate în tabelul lui Mendeleyev.
O moleculă este cea mai mică particulă a unei substanțe date (nu a unui element chimic) care își păstrează toate proprietățile chimice. O moleculă constă din doi sau mai mulți atomi ai unuia sau mai multor elemente chimice.
Cantitatea de substanță este o cantitate fizică care caracterizează numărul acelorași unități structurale conținute în substanță.
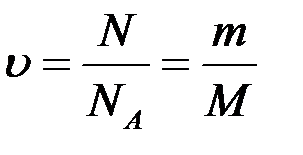
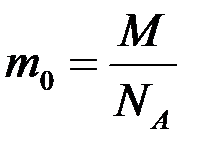
MOL este cantitatea unei substanțe egală cu 6,02. 10 23 unități structurale ale acestei substanțe - molecule (dacă substanța este constituită din molecule), atomi (dacă este o substanță atomică), ioni (dacă substanța este un compus ionic).
Ecuația de bază a MKT:
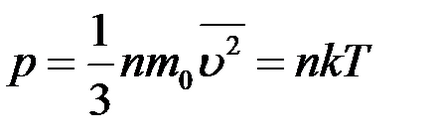
Ecuația de stare a unui gaz ideal:
Esteoprocese și legi privind gazele:

Lecția practică 6.
Articole similare
Trimiteți-le prietenilor: