Faptul că temperatura apei sub gheață la adâncimi în lacuri și râuri este de 4 grade peste zero este cunoscută de mulți, dar, așa cum arată discuțiile din unele forumuri, nu toată lumea înțelege cauza acestui fenomen. Uneori, o creștere a temperaturii este asociată cu presiunea unui strat gros de gheață deasupra apei și cu o schimbare a temperaturii de înghețare a apei. Dar majoritatea celor care au studiat cu succes fizica la școală vor spune cu încredere că temperatura apei la adâncime este legată de un fenomen fizic cunoscut - o schimbare a densității apei cu temperatură. La o temperatură de + 4 ° C, apa proaspătă dobândește cea mai mare densitate.
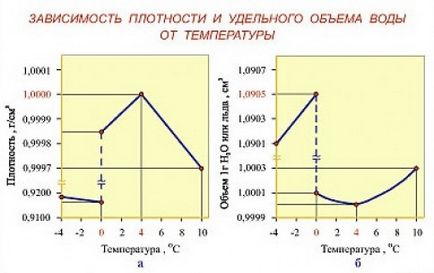
La temperaturi apropiate de 0 ° C, apa devine mai puțin densă și mai ușoară. De aceea, când răcirea apei în rezervor până la + 4 ° C prin convecție amestecare se oprește apa, răcirea ulterioară a acestuia are loc numai în detrimentul conductivității termice (asa cum este in apa nu este foarte mare) și procesele de răcire cu apă sunt încetinit dramatic. Chiar și în înghețuri severe, într-un râu adânc sub un strat gros de gheață și un strat de apă rece, va fi întotdeauna apă cu o temperatură de +4 ° C. Numai iazurile mici și lacurile îngheață până la fund.

Am decis să ne dăm seama de ce apa se comportă atât de ciudat când se răcește. Sa dovedit că nu a fost găsită încă o explicație exhaustivă a acestui fenomen. Ipotezele existente nu au găsit încă confirmare experimentală. Trebuie să spun că apa nu este singura substanță care are proprietatea de a se extinde cu răcire. Un comportament similar este de asemenea caracteristic pentru bismut, galiu, siliciu și antimoniu. Cu toate acestea, este apa care provoacă cel mai mare interes, deoarece este o substanță foarte importantă pentru viața omului și întreaga lume a plantelor și animalelor.
Una dintre teorii este existența în apă a două tipuri de nanostructuri de densitate mare și joasă, care variază în funcție de temperatură și determină o schimbare anormală a densității. Oamenii de știință care studiază procesele de topire se topesc, au prezentat următoarea explicație. Când lichidul este răcit sub punctul de topire, energia internă a sistemului scade, mobilitatea moleculelor scade. În același timp, rolul legăturilor intermoleculare este mărit, datorită căruia se pot forma diferite particule supramoleculare. Experimentele oamenilor de știință cu oterfenil lichid supraîncălzit au permis să se presupună că în lichidul suprasolicitat cu timpul se poate forma o "rețea" dinamică a unor molecule mai dens ambalate. Această rețea este împărțită în celule (zone). Reambalările moleculare din interiorul celulei determină viteza de rotație a moleculelor din ea și o rearanjare mai lentă a grilei în sine conduce la o modificare a acestei viteze cu timpul. Ceva de genul asta se poate întâmpla în apă.
Cu toate acestea, vibrațiile termice ale moleculelor de apă și interacțiunea cu alte molecule din afara clusterului preveni o astfel de combinație, respingând valoarea unghiului legăturii de hidrogen de 109.47 grade de echilibru valoare. Pentru a cuantifica cumva procesul de deformare unghiulară, Matsumoto si colegii au emis ipoteza existenței apei în microstructurilor tridimensionale care seamănă cu poliedre convex cav. Mai târziu, în următoarele publicații, ei au numit astfel microstructuri vitrite. În ele, moleculele de apă sunt vârfurile, rolul marginilor este jucat de legăturile de hidrogen, iar unghiul dintre legăturile de hidrogen este unghiul dintre coaste în vitrină.
Potrivit teoriei lui Matsumoto, există o mare varietate de forme de vitriol, care, ca elementele de mozaic, formează cea mai mare parte a structurii apei și care umple în mod egal întregul volum.
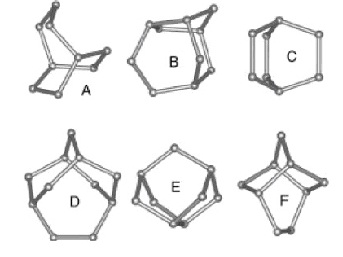
În figură există șase vitrificări tipice care formează structura internă a apei. Bilele corespund moleculelor de apă, segmentele dintre bile reprezintă legături de hidrogen. Fig. din articolul lui Masakazu Matsumoto, Akinori Baba și Iwao Ohminea.
Moleculele de apă tind să creeze unghiuri tetraedrice în vitrici, deoarece vitritele trebuie să aibă cea mai mică energie posibilă. Cu toate acestea, datorită mișcărilor termice și interacțiunilor locale cu alte vitrioli, unele vitriole iau configurații structurale de neechilibru care permit întregului sistem să obțină cea mai mică valoare energetică dintre cele posibile. Au fost numiți frustrați. În cazul în care volumul cavității este maximizat la o anumită temperatură în vitrită nemobilată, atunci vitriații frustrați, pe de altă parte, au cel mai mic volum posibil. Simularea computerizată, efectuată de Matsumoto, a arătat că volumul mediu al cavităților vitriatice scade liniar cu creșterea temperaturii. În același timp, vitrificiul frustrat își reduce în mod semnificativ volumul, în timp ce volumul cavității vitriului nemobilat aproape nu se schimbă.
Deci, comprimarea apei cu temperaturi în creștere, conform oamenilor de știință, este cauzată de două efecte concurente - alungirea legăturilor de hidrogen, ceea ce conduce la o creștere a volumului de apă și o scădere a volumului de cavități a vitriților frustrați. La intervalul de temperaturi de la 0 la 4 ° C, ultimul fenomen, după cum se arată prin calcule, este predominant, ceea ce duce în cele din urmă la compresia observată a apei cu creșterea temperaturii.
Această explicație se bazează până acum doar pe modelarea computerizată. Este foarte dificil să confirmați experimental. Studiul proprietăților interesante și neobișnuite ale apei continuă.
Articole similare
Trimiteți-le prietenilor: