Pagina 2 din 5
În tabel. 2 prezintă medicamentele utilizate în chimioterapie pentru cancer și caracteristicile acțiunii lor sunt rezumate în secțiunea Farmacopeea. Cu toate acestea, există câteva puncte importante care ar trebui subliniate în legătură cu utilizarea acestor medicamente în tumorile de chimioterapie.
Mecanism de acțiune
Agenții citotoxici pot întrerupe creșterea celulelor și divizarea lor, acționând prin diverse mecanisme. În Fig. 1 prezintă punctele de aplicare a acțiunii agenților citostatici pe baza biochimiei moleculare a celulelor.
Tabelul 2. Unele medicamente utilizate în chimioterapie pentru cancer
Ifosfamida (Ifosfamida)
Carmustine (carmustina)
Lomustine (Lomustine)
Melfalan (Melphalan)
Myelosan (busulfan)
tiotepa
Treosulfan (Treosulfan)
hlorbutin
ciclofosfamidă
Embihin (Mustin)
Estratsit
Deoksikoformitsin (Deoxicoformicin)
mercaptopurina
metotrexat
Thioguanină Fluorouracil
citarabină
Actinomicina D
bleomicina
doxorubicină
mitoxantrona
mitomicina
Epirubicin (Epirubicin)
- Hormoni și antagoniști ai hormonilor Antiestrogeni
tamoxifen
toremifen
antiandrogeni
ciproteron
glucocorticoizi
Estrogeni, de exemplu stilbestrol
Progestogeni, de exemplu medroxiprogesteron
Agoniști LHRH
Buserelin (Buserelin)
Goserelin (Goserelin)
Inhibitori de aromatază
aminoglutetimidă
- Vinca alcaloizi roz
vinblastina
Vinciristina Windesin (Vindesină)
Etoposida (VP 16)
Tenoposidul (VM 26)
Interferonii (# 945; # 946; # 947;)
Interleukina 2
Factorul necrozei tumorii
Amsacrină (amsacrină)
hidroxiuree
dacarbazină
Carboplatina (Carboplatina)
Procarbazine Razoxane
cisplatină
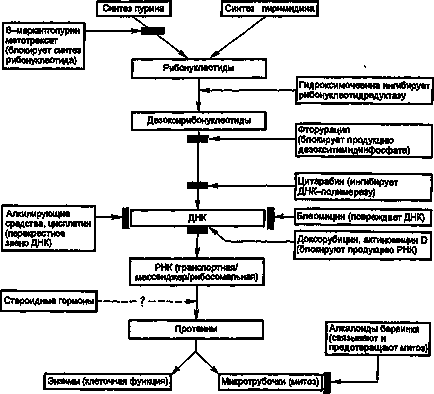
Fig. 1. Biochimie celulară, punctele de aplicare și mecanismul de acțiune al medicamentelor citotoxice.
Faptul că mecanismul de acțiune al agenților citotoxici este diferit face posibilă producerea unei tulburări biochimice cumulate în celulă în timpul tratamentului prin combinarea utilizării medicamentelor cu diferite mecanisme de acțiune.
Efectele agenților citotoxici asupra diferitelor faze ale ciclului celular
În Fig. 2 prezintă mai multe faze într-un ciclu regulat de celule care sintetizează ADN-ul.
Faza G1 este faza de odihnă, durata căreia determină ciclul de viață al celulei. Ea vine după finalizarea divizării (mitoză). In timpul fazei G1 sinteza ADN-ului nu se produce, dar sinteza de ARN și proteine este normală, iar în continuare celula intră în faza de S. Cu toate acestea, după mitozei, celulele se pot muta într-alta, diferită de odihnă fază G0, atunci când ieșirea celulele din bucla, dar încă capabil la proliferare.
Faza S este faza sintezei ADN care are loc după faza G1. Aceasta este precedată de o creștere a ratei de sinteză a ARN. Se termină cu o dublare a conținutului de ADN din celule și producția de cromatide soratice.
Faza G2 este, de asemenea, o fază de odihnă care apare imediat după faza S. Sinteza ADN-ului încetează, dar sinteza ARN-ului și a proteinelor continuă.
Faza M (mitoză)
În timpul mitozei, rata de sinteză a proteinelor și ARN scade. În acest stadiu, cromozomii contractează și separă cromatina soră, celulele se împart și din nou apar fazele restului.
Diferiți agenți citotoxici pot acționa pe diferite faze ale ciclului celular, așa cum se arată în Fig. 2. Pe baza observațiilor prezentate, se pot trage anumite concluzii.
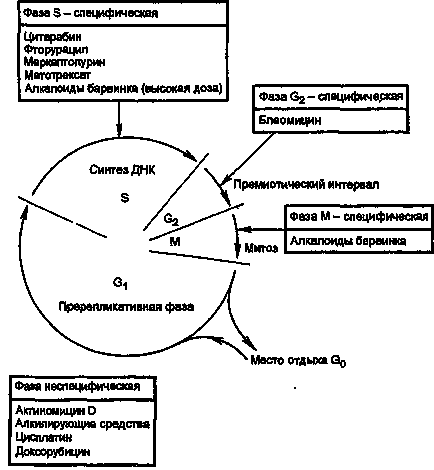
Fig. 2. Ciclul celular și timpul de acțiune al medicamentelor citotoxice.
a. Efectul fracțiunii de creștere asupra eficacității chimioterapiei
Fracțiunea de creștere este partea celulelor care se află în ciclu în momentul de față. Acesta este un factor important care determină răspunsul tumoral la chimioterapie, deoarece tumorile cu un factor de creștere ridicat sunt în general mai sensibile la chimioterapie. În contrast, celulele din faza G0 sunt rezistente la agenții citotoxici.
b. Efectul ratei ciclului celular asupra eficacității chimioterapiei
Cu cât este mai rapid ciclul celular, cu atât este mai probabil ca tratamentul cu un agent citotoxic să "prindă" celula într-o perioadă sensibilă. Din păcate, în general, cu cât este mai rapid ciclul celular, cu atât este mai malignă tumoarea. In paralel cu aceste celule normale cu un ciclu rapid, cum ar fi măduva osoasă, epiteliul tractului gastrointestinal, țesutul limfoid, pielea, suferă tratamentul medicamentelor citotoxice la cea mai mare măsură. În acest sens, tratamentul cu agenți citotoxici este efectuat în mod obișnuit în cicluri cu un interval de 3-4 săptămâni și nu este lung, deoarece această tehnică permite recuperarea celulelor sensibile, cum ar fi măduva osoasă.
în. Sincronizarea ciclului celular în celulele tumorale
Teoretic, dacă majoritatea celulelor tumorale sunt sincronizate în faza sensibilă a ciclului, șansa ca tumora să răspundă la efectul agentului citotoxic este mai mare. Cel mai puține celule sunt în faza sensibilă, cu atât este mai puțin eficace tratamentul și cu atât este mai necesară o terapie prelungită cu o creștere ulterioară a toxicității. Uneori, se face o încercare de a implica celule într-un ciclu, de exemplu celulele cancerului de sân, cu ajutorul estrogenilor, deși eficacitatea acestei abordări nu a fost dovedită.
În mod alternativ, agenții citotoxici pot fi utilizați pentru a opri celulele în diferite stadii ale ciclului, modificând astfel efectele altor terapii.
De exemplu, celulele pot fi aduse într-o stare folosind alcaloid mitoza sincron conținute în plantă periwinkle, apoi, atunci când acestea sunt supuse ele influențează faza S inhibitor al sintezei ADN-ului, de exemplu citarabină. Practic, pentru a demonstra cât de mult aceste condiții preliminare sunt realizate la terapia combinată, este dificil, dar la leucemii experimentale la șoareci este stabilit sau instalat cu siguranță.
Efectul dimensiunii tumorii asupra tratamentului
Tumorile mari sunt relativ rezistente la agenții citotoxici din două motive. În primul rând, multe celule se găsesc într-o fază de repaus, în care nu reacționează la medicamente. În al doilea rând, penetrarea substanțelor medicinale prin țesuturi slab furnizate de sânge este insuficientă pentru a ajunge la concentrații citotoxice pentru o lungă perioadă de timp fără a provoca complicații toxice sistemice toxice. Cel mai bine este eliminarea masei tumorale mari și a chimioterapiei dacă este posibil, expunerea celulelor tumorale rămase (cu excepția tumorilor foarte sensibile la chimioterapie).
etc. Kinetica morții celulare
Deoarece agenții citotoxici acționează mai eficient asupra celulelor în faze specifice ale ciclului celular, ei distrug o parte a acestuia, care este în această fază în timpul expunerii la aceste medicamente în timpul tratamentului, dar acest lucru nu este un anumit număr de celule. Mai mult, deoarece multe tumori umane sunt eterogene în compoziția populațiilor celulare, sensibilitatea diferitelor celule la chimioterapie poate de asemenea să difere. În acest sens, este dificil să distrugeți toate celulele tumorale, deși acesta este tocmai obiectivul chimioterapiei. Cu toate acestea, din moment ce există o moarte portiune deterministă a celulelor tumorale chimioterapie poate reduce semnificativ greutatea tumorii si duce la remisie clinică se realizează relativ ușor, dar tumora nu complet eliminate. Acesta este cazul cancerului pulmonar cu celule mici. Amintiți-vă că, cu cât diviziunea celulelor este mai rapidă, cu atât mai ușor acestea vor muri sub influența unui agent chimioterapeutic și va apărea mai devreme remisia clinică. Din pacate, daca nu toate celulele tumorale dispar, celulele care se descompun repede sufera repede, asa cum se observa adesea in leucemia mieloida acuta sau in cancerul pulmonar cu celule mici.
e. Rezistența celulelor canceroase la agenții citotoxici
Așa cum sa indicat mai sus, celulele canceroase diferă în sensibilitatea lor față de droguri. În dezvoltarea rezistenței sunt implicate numeroase mecanisme biochimice, cum ar fi diferențele dintre enzimele metabolizatoare ale medicamentelor, mecanismele de detoxifiere și repararea ADN-ului. În ultimii ani, a fost identificată o formă specifică de rezistență la medicamente multiple, care este importantă în multe tumori. Acesta este un mecanism mediat prin intermediul glicoproteinei P, care "împinge" medicamentele citotoxice din celule înainte de a începe să acționeze. Această pompă poate fi inhibată, mecanismul de inhibare nu este pe deplin stabilizat, dar medicamente care sunt structurale diferite unul de altul, cum ar fi nifedipina, verapamil, ciclosporina și tamoxifenul, sunt eficiente. Aceste medicamente sunt utilizate în combinație cu agenți chimioterapeutici pentru a bloca glicoproteina și a elimina acest tip de rezistență la medicament. Cu tumori de sânge, au produs rezultate promițătoare, dar cu tumori solide, a fost mai dificil de depășit rezistența.
Medicamente pentru hormoni
Unele tumori sunt dependente de hormoni, de exemplu cancerul de sân sau de prostată, cancerul endometrial. În tratamentul pacienților cu astfel de tumori se utilizează hormoni sau antagoniștii lor.
In cancerul de san, sunt utilizate multe agenți hormonali, inclusiv antagonist tamoxifen estrogen si un HCWs progestinei oksiprogesteron goserelin agonist LHRH, precum aminoglutetimid inhibitor de aromatază. Toate acestea oferă eficacitate în aproximativ 30% din cazurile de cancer de sân, iar cu vârsta pacientului crește frecvența efectului pozitiv.
În trecut, estrogenii au fost utilizați pentru a trata cancerul de prostată, dar în prezent nu sunt utilizați din cauza efectelor secundare. S-a găsit agonist LHRH goserelin. Când se utilizează goserelin, poate apărea recidiva timpurie a tumorii și este prevenită prin utilizarea antiandrogenilor, de exemplu, acetat de cyproteron.
mijloace de imunoterapie
În ultimii ani, a existat un interes în utilizarea medicamentelor imunologice pentru tratamentul pacienților cu cancer. Începutul a fost făcut folosind interferonii. Interferonii sunt eficiente în unele forme de leucemii, limfoame, acestea pot crește, de asemenea, activitatea anumitor agenți citotoxici utilizați în combinație.
Recent, cu cancer renal, se utilizează citokina interleukină-2. Eficacitatea terapiei cu 20-30%, cu un interleukina-2 și este ușor mai mare atunci când sunt combinate cu celule LAK (limfokinele celule killer activate).
Articole similare
Trimiteți-le prietenilor: