INDICAȚII HIDROCARBONI SUNT O LINIE A ACETILENULUI (ALKINA)
Alcinele sunt hidrocarburi alifatice nesaturate, în molecule de care există o legătură triplă între atomii de carbon.
Hidrocarburile din seria acetilenă sunt compuși și mai nesaturați decât alchenele corespunzătoare (cu același număr de atomi de carbon). Acest lucru este evident din compararea numărului de atomi de hidrogen din serie:
1. STRUCTURA ALKINEI
Primul și principalul reprezentant al seriei omoloage de alchine este acetilenă (etiină) C2H2. Structura moleculei sale este exprimată prin formule: Prin numele primului reprezentant al acestei serii - acetilenă - aceste hidrocarburi nesaturate se numesc acetilene.
În alchine, atomii de carbon sunt în starea a treia a valenței (sp-hibridizare). În acest caz, se formează o legătură triplă între atomii de carbon, constând dintr-o legătură s- și două p-legături. Lungimea legăturii triple este de 0,12 nm, iar energia formării sale este de 830 kJ / mol. Modelele structurii spațiale ale acetilenei sunt prezentate în figură: 2. NOMENCLATURA ȘI ISOMERIA
Nomenclatura. Conform nomenclaturii sistematice, se cheamă hidrocarburi acetilenice, înlocuind sufixul - în alcani cu sufixul - în. Compoziția circuitului principal include în mod necesar o legătură triplă, care determină începutul numerotării. Dacă molecula conține atât o dublă, cât și o legătură triplă, atunci preferința în numerotare dă o dublă legătură:
Prin nomenclatura rațională, compușii de alchin sunt denumiți derivați ai acetilenei.
Radicalii nesaturați (alchin) au nume trivial sau sistematice:
Izomeri. Izomerismul hidrocarburilor alchinice (precum și hidrocarburile alchenice) este determinat de structura lanțului și de poziția în el a unei legături multiple (triple):
3. PRODUCEREA ALKINELOR
Acetilena în industrie și în laborator poate fi obținută în următoarele moduri:
1. Descompunerea la temperaturi înalte (cracare) a gazului natural - metan:
2CH4 1500 ° C -> HC3CH + 3H2
2. Descompunerea CaC2 cu apă cu carbură de calciu. care se obține prin sinterizarea vaporilor calcaroși de CaO cu cocs:
CaO + 3C 2500 ° C -> CaC2 + CO
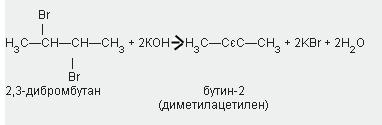
3. în laborator, derivații acitilenului pot fi sintetizați din derivați dihalogeni conținând doi atomi de halogen la unul sau atomi de carbon adiacenți, prin acțiunea unei soluții de alcool alcalin:
4. PROPRIETĂȚI FIZICE ȘI CHIMICE
proprietățile fizice. Hidrocarburile acetilenice conținând două până la patru atomi de carbon în moleculă (în condiții normale) sunt gazele care încep cu lichide C5H8, iar alchinii mai mari (cu C16H30 și mai mari) sunt solide. Proprietățile fizice ale unor alchine sunt prezentate în Tabelul. 1.
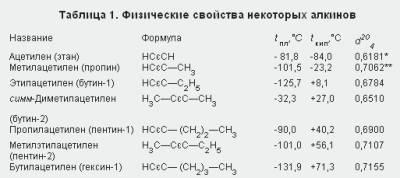
** La o temperatură de -50 ° C
Proprietăți chimice. Proprietățile chimice ale alchinelor sunt determinate de legătura triplă, caracteristicile structurii sale. Alcinele sunt capabile să se alăture reacțiilor de adiție, substituție, polimerizare și oxidare.
Reacții de adiție. Fiind compuși nesaturați, alchinii vin mai întâi în reacția de adiție. Aceste reacții se desfășoară treptat: prin adăugarea unei singure molecule de reactiv, legătura triplă este mai întâi convertită la o dublă legătură și apoi, pe măsură ce ea continuă să fie adăugată, într-o legătură simplă. Se pare că alchinele, care posedă două legături p, ar trebui să reacționeze mult mai activ în reacțiile de adăugare electrofilă. Dar acest lucru nu este adevărat. Atomii de carbon din moleculele de alchin se află mai aproape unul de celălalt decât în alchenă și au o electronegativitate mai mare. Acest lucru se datorează faptului că electronegativitatea atomului de carbon depinde de starea de valență. Prin urmare, electronii p, fiind mai aproape de nucleele de carbon, prezintă o activitate mai mică în reacțiile de atașare electrofilă. În plus, proximitatea nucleelor atomice încărcate pozitiv, capabile să respingă reactivii electrofili care se apropie (cationi), este afectată. În același timp, alchinele pot intra în reacții de adăugare nucleofilă (cu alcooli, amoniac etc.).
1. Hidrogenarea. Reacția se desfășoară în aceleași condiții ca și în cazul alchenelor (catalizatori Pt, Pd, Ni). În reducerea alchinelor, se formează mai întâi alchene și apoi alcani: CH "CH + H2 - CH2 = CH2 + H2 - CH3 - CH3
2. Halogenație. Această reacție are loc la o viteză mai mică decât în seria de hidrocarburi etilenice. Reacția trece, de asemenea, în mod static:
3. Hidrohalogenația. Reacțiile de adiție de halogenuri de hidrogen, precum și de halogeni, se desfășoară în principal prin mecanismul de adăugare electrofilă:
A doua moleculă de halogenură de hidrogen se alătură în conformitate cu regula Markovnikov.
4. Adăugarea apei (reacția lui MG Kucherov, 1881). Catalizatorul este sarea de mercur:
HCS + HOH -> 2 = CH-OH> (produs instabil intermediar) (alcool vinilic)
Compusul intermediar instabil - alcool vinilic - este rearanjat în aldehidă acetică.
5. Înțărcarea acidului prusic:
НСєСН + HCN cat. -> H2C = CH-CN (acrilonitril)
Acrilonitrilul este un produs valoros. Se utilizează ca monomer pentru fabricarea fibrelor sintetice - nitron.
6. Adăugarea de alcool. Ca urmare a acestei reacții, se formează eteri vinilici simpli (reacția lui AE Favorsky):
Adăugarea de alcooli în prezența alcoolaților este o reacție tipică de adăugare nucleofilă.
Reacția de izomerizare. Hidrocarburile acetilene, cum ar fi alcani și alchene, sunt capabile de izomerizare cu mișcarea unei legături triple:
Reacții de polimerizare. Acetilena, în funcție de condițiile de reacție, poate forma diferite produse de polimerizare - liniară sau ciclică:
НСєСН + НСєСН -> НСєСН-СН = CH2 [sup] (la 80gt și Cu2Cl2, se formează vinilacetilenă)
Aceste substanțe prezintă un mare interes. De exemplu, când clorura de hidrogen clorură este adăugată la vinilacetilenă, se formează cloropren, care ca monomer este utilizat la producerea cauciucului de cloropren:
Reacția de oxidare. Acetilenii sunt ușor acidifiați. În acest caz, molecula se descompune în locul legăturii triple. Dacă acetilenă este trecut printr-un oxidant (soluție apoasă de permanganat de potasiu), soluția se decolorează rapid. Această reacție este calitativă pentru multiple (dublu și triple) obligațiuni:
Cu arderea completă a acetilenei în aer se formează două produse: monoxid de carbon (IV) și apă:
În caz de ardere incompletă se formează carbon (negru de fum):
5. REPREZENTANȚII INDEPENDENȚI
Acetilena este un produs valoros pentru industria chimică. Produce cauciuc sintetic, aldehidă acetică și acid acetic, alcool etilic și multe alte substanțe.
Vinylacetilenă (butene-1-în-3) HСС-СН = СН2 - gaz cu un miros neplăcut. Când reducerea formează butadienă-1,3 și cu adăugarea de acid clorhidric - 2-clorbutadien-1,3 (cloropren).
1) poate fi utilizat drept combustibil pentru sudarea cu gaz și tăierea metalelor;
2) este de asemenea utilizat pentru sinteza diferiților compuși organici;
3) ca urmare a adăugării clorului în acetilenă, se obține un solvent - 1,1,2,2-tetracloretan. Prin prelucrarea ulterioară a tetracloretanului se obțin alte cloro-derivați;
4) după îndepărtarea acidului clorhidric din 1,1,2,2-tetracloretan, se formează un tricloretan de înaltă calitate, utilizat pe scară largă pentru curățarea hainelor: CHCII = CCI2;
5) în cantități mari, acetilenă merge la producția de clorethenă sau clorură de vinil, care polimerizează clorura de polivinil (utilizată pentru a izola firele, a face haine de ploaie, piele artificială, țevi și alte produse);
6) alți polimeri sunt obținuți din acetilenă, care sunt necesari în producția de materiale plastice, cauciucuri și fibre sintetice.
24 întrebări Metode de obținere a derivaților halogenați ai hidrocarburilor saturate
Substituirea hidrogenului în hidrocarburile limitative pentru halogen. Atunci când halogenul acționează asupra hidrocarburilor saturate sub influența luminii, se formează halogenalchine ca urmare a substituției atomilor de hidrogen.
CH4 + Cl2CH3CI + HCI
Clorura de metil metan
Totuși, se formează, de asemenea, cantități semnificative de derivați polihalogeni.
În halogenarea directă a hidrocarburilor mai complexe, înlocuirea hidrogenului poate avea loc la diferiți atomi de carbon. De exemplu, deja cu clorurarea propanului, reacția are loc în două direcții: un amestec de două haloalchil
Obținerea de hidrocarburi nesaturate. Halogenalcinele se formează când se adaugă halogenuri de hidrogen la hidrocarburile etilenice
Atunci când halogeni sunt atașați la hidrocarburi etilenice sau la hidrocarburi acetilen-halogenate, se formează derivați dihalogeni. Ca urmare a adăugării de halogeni, diferiți derivați de tetrahalogen pot fi obținuți din hidrocarburi acetilenă și dienă.
Noțiuni de bază de la alcooli. Cea mai convenabilă cale de a prepara haloalchili este înlocuirea grupării hidroxil a alcoolilor R-OH cu halogen.
Dacă cineva acționează asupra hidrogenului cu o halogenură de hidrogen, atunci haloalchil
Cu toate acestea, cu formarea haloalchilului și a apei, acesta din urmă va hidroliza haloalchilul și, prin urmare, o astfel de reacție este reversibilă. Pentru a obține un randament bun de haloalchil, un exces de halogenură de hidrogen este introdus în reacție sau este condus în prezența agenților de îndepărtare a apei (acid sulfuric concentrat). De exemplu:
Pentru producerea haloalchililor, efectul asupra alcoolilor de compuși halogeni ai fosforului este convenabil. De exemplu:
Trimiteți-le prietenilor: