În anumite condiții, două faze diferite ale aceleiași substanțe (de exemplu, lichid și gaz) pot coexista între ele timp îndelungat. Pentru aceasta, este necesar să se îndeplinească următoarele condiții la limita a două faze:
Derivează condițiile de echilibru de la unele principii, distribuții!
Prima condiție este necesară pentru echilibrul termic, a doua pentru echilibrul mecanic, iar a treia pentru echilibru în raport cu numărul de particule. Dacă niciuna dintre aceste condiții nu este îndeplinită, va exista fie un flux de căldură între faze, fie o forță va acționa asupra limitei de fază sau particulele vor trece de la o fază la alta.
Potențialul chimic este legat de energia Gibbs de relație
Pentru un gaz Van der Waals, se poate trasa o linie care să corespundă echilibrului fazelor. Această linie este numită binodală. Poziția binodului este determinată de egalitatea suprafețelor tăiate de linia orizontală de la dependența p (V).
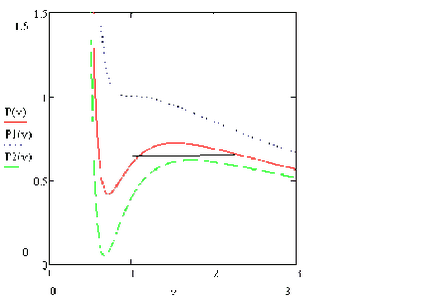
Linia corespunzătoare punctelor extremum pentru izoterme diferite este numită spinodal.
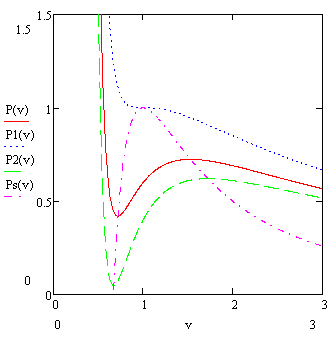
Se poate arăta că spinodalul este întotdeauna în interiorul binodului. La fel ca și spinodul, binodul are întotdeauna un maxim în punctul critic. În interiorul spinodului, o stare de o singură fază nu poate exista datorită instabilității sale - există întotdeauna o stare în două faze. Între spinodal există o regiune de stări metastabile. Adică, afirmă că există într-un timp finit, dar din cauza fluctuațiilor aleatorii care trec cu timpul într-o stare în două faze. În spatele binodului este o regiune a stărilor unifazice, atunci când existența unei stări în două faze este imposibilă.
Dacă gazul van der Waals este comprimat izotermic, începând cu volume mari, vor apărea următoarele. În primul rând, în volum va fi gaz (abur), apoi va apărea o picătură de lichid, atunci va exista mai mult fluid până când acesta va prelua întregul volum. Apoi va exista doar un lichid care este practic incompresibil. Trecerea de la o stare lichidă la o stare solidă sau de la gaze la lichid este numită o tranziție de fază de prim ordin. În acest caz, entropia specifică a substanței și volumul ei specific se confruntă cu un salt. Pentru tranzițiile de fază de al doilea tip, aceste cantități se suprapun.
Cu toate acestea, un alt scenariu este posibil, legat de existența unor faze metastabile. În acest caz, dacă nu există perturbații în sistem și substanța nu are practic impurități, sub compresia izotermică a gazului, tranziția sa la starea lichidă nu va începe la binodală, ci la un volum mai mic. Această stare de abur este numită "suprasaturate". La rândul său, cu expansiunea lichidului după binodal, va exista un "lichid supraîncălzit". Ambele stări sunt metastabile în sensul că sunt stabile în ceea ce privește perturbațiile mici, dar sunt instabile în ceea ce privește perturbațiile finite. Dar din moment ce perturbațiile sunt în mare parte aleatorii, devine mai devreme sau mai târziu revolta finală. În acest caz, starea metastabilă se descompune pentru a forma o fază stabilă. De exemplu, când apa este încălzită, fierberea ei nu poate începe la 100 ° C, ci la o temperatură ușor mai ridicată.
Principalele tipuri de stări metastabile sunt supraîncălzirea și subrăcirea.
Subcooling - răcirea materiei sub temperatura de tranziție de echilibru către o altă stare agregată (fază); un caz special de transferare a sistemului într-o stare metastabilă. În secvența tranzițiilor de fază de la faze de temperatură ridicată la temperaturi scăzute (vaporii cristalului lichid I cristal II), este posibilă subcoolizarea fiecărei faze în raport cu faza ulterioară. Supercoolizarea necesită o tranziție de fază de ordinul întâi la o rată finită. Supercoolizarea mare a unui sistem omogen poate fi cauzată de absența embrionilor din faza concurențială sau de creșterea lor foarte lentă din cauza mobilității mici a moleculelor.
Pentru picăturile metalice s-au observat următoarele supercoolări: unde este temperatura de cristalizare a echilibrului: 52 K (Hg), 122 K (Sn), 296 K (Ge), 277 K (Cu). În atmosferă, apa poate fi, de asemenea, într-o stare supercoolată. De exemplu, picături mici de apă pot fi în atmosferă în stare lichidă până la -40 ° C.
Supraîncălzirea este încălzirea fazei condensate la o temperatură care depășește temperatura de echilibru cu o altă fază, astfel încât faza inițială să fie într-o stare metastabilă. Supraîncălzirea ulterioară corespunde cu cea a spinodului. Lichidele reușesc să se supraîncălzească cu mult peste temperatura de echilibru cu aburi. Supraîncălzirea poate fi realizată nu numai prin creșterea. dar și prin scăderea presiunii externe de mai jos.
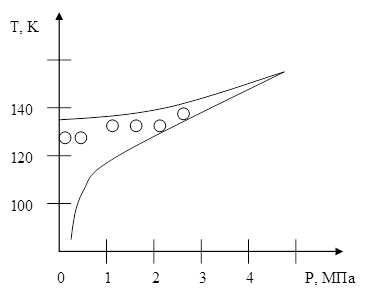
În figura 5, cercurile indică valori experimentale pentru fierberea omogenă a argonului în încălzirea izobarică într-un tub de sticlă: curba inferioară este linia de saturație (binodală), curba superioară fiind cea spinodală.
Articole similare
-
Secvența de dezvoltare 2d desen al blocului de roți dințate în sistem ascon compass 3d -
-
Cum a evoluat viața pe pământ - pământul ca planeta sistemului solar și - leagănul - vieții
Trimiteți-le prietenilor: