Prin metale se înțelege un anumit grup de elemente situate în partea stângă a tabelului periodic al lui DI Mendeleev.
Particularitatea structurii substanțelor metalice constă în faptul că toate acestea sunt construite în principal din astfel de atomi, în care electronii externi sunt ușor legați de nucleu. Aceasta determină, de asemenea, natura specifică a interacțiunii chimice a atomilor de metal și a proprietăților metalice.
Teoria stării metalului privește metalul ca o substanță constând din ioni încărcați pozitiv înconjurați de particule încărcate negativ - electroni care sunt legați în mod liber de nucleu. Acești electroni se mișcă continuu în interiorul metalului și aparțin nu numai unui atom, ci întregului set de atomi.
O caracteristică caracteristică a structurii atomice cristaline a metalelor este prezența unui gaz electron în interiorul unui metal, legat slab de ionii încărcați pozitiv.
Toate metalele pot fi împărțite în două grupe mari - metale feroase și neferoase.
Metalele feroase au o culoare gri închis, o densitate mare (cu excepția pământului alcalin), un punct de topire ridicat, o densitate relativ înaltă și, în multe cazuri, polimorfism. Cel mai tipic metal al acestui grup este fierul.
Metalele neferoase au de multe ori o colorare caracteristică: roșu, galben, alb. Acestea au o mare plasticitate, duritate scăzută, un punct de topire relativ scăzut, sunt caracterizate de absența polimorfismului. Cel mai tipic metal din acest grup este cuprul.
Metalele pot fi subdivizate după cum urmează:
1. Metale de fier - fier, cobalt, nichel și un mangan aproape de ele. Cobalt, nichel și mangan sunt adesea folosite ca aditivi de fier aliaje, precum și baza pentru aliajele respective, similare în proprietățile lor la oțeluri înalt aliate.
2. Metale refractare. a cărui punct de topire este mai mare decât cel al fierului (adică 1539 ° C). Acestea sunt aplicate ca aditivi la oțelurile aliate și, de asemenea, ca bază pentru aliajele corespunzătoare.
3. Metale pământurilor rare (RMZ) - lantan, ceriu, neodim, praseodim, etc numit lantanidelor joinable și similare acestora în proprietăți, ytriu și scandiu ..
4. Nu se aplică metale alcalino-pământoase în stare metalică liberă, cu excepția cazurilor speciale.
Metalele neferoase sunt împărțite în:
1. Metale ușoare - beriliu, magneziu, aluminiu, care au o densitate scăzută.
2. Metale nobile - argint, aur, metale din grupa de platină.
3. Metale - zinc fusibile, cadmiu, mercur, staniu, plumb, bismut, taliu, antimoniu și elemente cu proprietăți metalice - galiu, slabiti germaniu.
Structura cristalină a metalelor
Orice substanță poate fi în trei stări agregate - solide, lichide și gazoase.
Starea cristalină este în primul rând caracterizată printr-un aranjament definit, regulat de atomi în spațiu.
Într-un cristal, fiecare atom are unul și același număr de atomi apropiați - vecini aflați la aceeași distanță de el.
Aranjamentul atomilor într-un cristal este reprezentat sub forma schemelor spațiale, sub forma așa-numitelor celule de cristal. O celulă de cristal elementar este cel mai mic complex de atomi, care, cu repetarea repetată în spațiu, permite reproducerea unei laturi de cristal spațial.
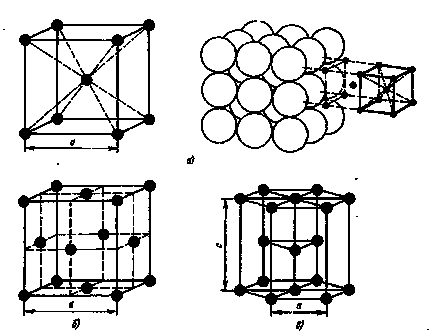
Fig.1. Tipuri de celule cristaline:
a - volum cubic centrat, b - centru cubic centrat; cu - hexagonale închise
atomii de metal aspiration ocupă locul cel mai apropiat unul de altul, conduc la formarea următoarelor tipuri de zăbrele (Figura 1.): corp centrat cubic volum, și cubice cu fețe centrate hexagonal ambalate aproape-(Fig.1).
Într-o latură centrată pe corp (ccc), atomii sunt localizați la colțurile cubului și un atom aflat în centrul volumului cubului. o rețea cubică cu fețe centrate (fcc) situate în atomul a- colțuri de cub și centrul fiecărei fețe, în atomii cu zăbrele hexagonale sunt situate la colturi si centrul bazei prisme hexagonale și trei atomi în plan secundar prismă.
Metale Cubic BCC sunt :. Na, Li, W, V, Cr, etc. zăbrele cubi sunt FCC Pb, Ni, Ag, Au, Cu si altele.
Dimensiunile rețelei cristaline sunt caracterizate de parametri sau perioade de zăbrele. Gridul cubic definește un parametru - lungimea marginii cubului. Parametrii au magnitudine de ordinul dimensiunilor atomice și sunt măsurate în angstromuri.
Unele metale au o latură tetragonală; se caracterizează prin faptul că muchia c nu este egală cu muchia a. Raportul dintre acești parametri caracterizează așa-numitul grad de tetragonalitate. Numărul de atomi la cea mai apropiată distanță de un atom dat este numit numărul de coordonare. De exemplu, un atom dintr-o latură simplă cubică are șase vecini apropiați echidistanti, adică numărul de coordonare al acestei rețele este 6 (figura 2).
Atomul central al latticei centrate pe corp are opt vecini apropiați echidistanti; numărul de coordonare al acestei lattice este 8. Numărul de coordonare pentru o latură centrat pe față este 12. În cazul unei laturi hexagonale închise, numărul de coordonare este 12.
Articole similare
Trimiteți-le prietenilor: