Titlul lucrării: STUDIUL SPECTRUMULUI EMISIILOR DE HIDROGEN ATOMIC ÎN ZONA VIZIBILĂ (SERIA BALMER)
Specializarea: Fizica
Descriere: Lab spectru de emisie № 16 STUDIUL hidrogenului atomic în vizibil seria Balmer Obiectiv: Pentru a determina frecvența liniilor spectrale din spectrul vizibil și emisia de hidrogen pentru a calcula valoarea constantei Rydberg. Echipament:
Mărime fișier: 69,5 KB
Lucrarea a fost descărcată: 18 persoane.
Lucrarea de laborator № 16
STUDIUL SPECTRULUI EMISIILOR DE HIDROGEN ATOMIC ÎN ZONA VIZIBILĂ (SERIA BALMER)
Scopul lucrării. determină frecvențele liniilor spectrale din partea vizibilă a spectrului de emisii de hidrogen și calculează valoarea constantei Rydberg.
Echipamente. o lampă cu hidrogen, o lampă de neon, o lentilă, un monochromator UM-2 sau MUM.
Scurt informații teoretice
Emisia de lumină de către atomi are loc în loturi # 150; quanta în tranziția unui electron într-un atom dintr-o stare staționară în alta, energetic mai scăzută. Energia cuantică este h . unde h # 150; Constanta lui Planck,
# 150; frecvența radiațiilor emise.
Conform mecanicii cuantice, frecvența depinde de energia stărilor staționare ale unui electron într-un atom, după cum urmează:
unde E n și E k # 150; energia stadiilor inițiale și finale staționare ale atomului, respectiv; k # 150; numărul de nivel energetic al atomului pe care se produce tranziția electronului după radiație, n # 150; Numărul de nivel din care trece electronul atunci când atomul emite energie electromagnetică. R # 150; Constanta lui Rydberg; c = 3 ∙ 10 8 m / s # 150; viteza luminii în vid.
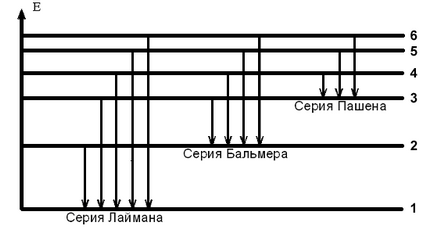
Liniile spectrului de hidrogen sunt grupate într-o serie (vezi figura 1).
O serie de linii Lyman apare în tranziția electronilor de la stările staționare energetic la cele mai înalte. Pentru aceste linii
k = 1, n = 2, 3, .... iar frecvențele sunt în regiunea invizibilă a spectrului ultraviolet.
Linii în partea vizibilă a spectrului # 150; Seria Balmer # 150; sunt caracterizate prin tranziții de electroni din state cu numere n = 3, 4, 5, ... la stări
cu numărul k = 2. Trecerea unui stat de electroni n = 3 stare cu k = 2 corespunde liniei roșii în spectrul, trecerea de la o stare de n = 4 într-o stare cu k = 2 # 150; linia verde-albastră și trecerea de la starea n = 5 la starea cu k = 2 # 150; purpurie în spectrul de hidrogen.
electroni Treceri la nivel cu numărul k = 3, cu niveluri mai mari de energie formează o serie de linii de PASCHEN, ale căror frecvențe sunt în domeniul infraroșu invizibil și t. D. Fiecare linie spectrală corespunde unui anumit val frecventa si lungimea . conectat prin relație
În această lucrare este necesar să se determine experimental frecvențele celor trei linii observate din seria Balmer. Folosind rezultatele obținute, se calculează constanta Rydberg din formula (1).
Frecvențele spectrului de hidrogen sunt măsurate utilizând un monochromator UM-2, schema optică a acestuia fiind prezentată în Fig. 2. Lumina de la lampa cu hidrogen 1 este focalizată de lentila 2 pe fanta de intrare 3 a monocromatorului. Decalajul se află în centrul lentilei 4 și intră în partea mobilă a monochromatorului, într-un așa-numit colimator. Rotiți butonul 5, puteți deplasa colimatorul de-a lungul axei optice. Trecând obiectivul 4, lumina cu un fascicul paralel cade pe prisma 6 și se descompune în spectru. Lentilele 7 focalizează spectrul în câmpul de observare. Observați spectrul prin ocularul 8. Ocularul are un inel de rulare, a cărui rotire poate obține cea mai clară imagine a observării spectrului. În partea inferioară a slotului 3 este un șurub cu micrometru, care vă permite să modificați lățimea slotului.
Imaginea spectrului este observată prin introducerea regiunii dorite în mijlocul câmpului vizual. Pentru aceasta, rotiți tamburul 9, situat în partea dreaptă a telescopului monocromatorului. Tamburul este echipat cu o scară care vă permite să determinați întoarcerile în grade. Diviziunea scării este de 2. Poziția liniei spectrale este calculată în momentul alinierii liniei cu săgeata # 150; un pointer în centrul câmpului vizual. Indicatorul săgeții și modelul spectrului ar trebui să fie observate în mod egal. Pentru a face acest lucru, setați ocularul la observația ascuțită a indicatorului de săgeți și apoi rotiți roata de mână 5 pentru a obține o imagine clară a observării spectrului. Fanta de intrare are un amortizor 10 care întrerupe fluxul luminos. În poziția de lucru, clapeta trebuie să fie deschisă.
Scala de tambur este clasificată la frecvențe. Pentru a face acest lucru, folosim un spectru bine studiat de emisii de neon, o descriere a cărei descriere este prezentată în Tabelul. 1.
Descrierea spectrului emisiilor de neon
Notă. Pentru a facilita observarea liniei roșii 1. roșu # 150; este afișată linia portocalie 2 și linia 3 toate parte galben roșu și galben a spectrului de neon o figură separată pe standul de laborator.
Ordinea de executare a muncii
1. Instalați lampa de neon de pe șina optică și direcționați radiația către fanta de intrare a monochromatorului. Setați lățimea minimă a slotului. Observând prin ocular spectrul de neon, combinați cu indicatorul de săgeată fiecare dintre liniile descrise în tabelul. 1. Valoarea unghiului de rotație pe scala tamburului și lungimea de undă din tabel. 1 pentru fiecare linie
în Tabelul. 2. Trecând de la liniile roșii, portocalii și galbene strălucitoare la liniile slabe din regiunile verzi și albastre ale spectrului, ar trebui să măriți treptat lățimea fantei.
Numărul liniei spectrului de frecvențe neonale
2. Folosind datele din tabel. 2, pentru a construi un grafic gradat al dependenței unghiului de rotație de frecvență. Când construiți o diagramă, respectați următoarele scale. Pe axa "frecvență" 1 cm ar trebui să corespundă la 10,10 12 Hz, pe axa "unghiul de rotație" 1 cm ar trebui să corespundă la 100 ° rotație a tamburului.
4. Introduceți în tabel. 3 citiri ale scalei de tambur corespunzătoare fiecăreia dintre liniile observate ale spectrului de hidrogen.
5. Utilizând graficul de calibrare construit, determinați frecvențele liniilor spectrului de hidrogen.
6. Conform fig. 1 setați numerele de nivel n și k ale stărilor inițiale și finale ale electronului pentru fiecare linie a spectrului de hidrogen. Rezultatele sunt prezentate în Tabelul. 3.
7. Din formula (1), calculați constanta Rydberg pentru fiecare linie din seria Balmer. Găsiți valoarea medie a constantei Rydberg și comparați-o cu valoarea tabelară R = 1,097 ∙ 10 7 m -1.
Linia spectrală a hidrogenului
Unghiul de rotație a tamburului (grade)
Nivel superior n
Numărul nivelului inferior
Rydberg
R (m-1)
1. De ce este luată spectrul de neon pentru absolvire? Este posibil să se utilizeze spectrul emisiilor unui alt element?
2. Listati seria de spectru de hidrogen. Ce tranziție corespunde titlului din fiecare serie?
3. Ce determină limita seriei? De ce intensitatea scade până la limita seriei?
4. Ce tranziții corespund liniilor părții vizibile a spectrului de hidrogen? Care este seria spectrală?
la lucrările de laborator nr. 16
Și alte lucrări care ar putea să te intereseze
Maroussia Churai Kostenko Lіna ROZDІL de znayshlas I Yakbi de ardere carte Pid oră Pozhezhi Poltavі în 1658 roku zgorіli OAO Toate documentele mіskih navele ref. Și ar fi posibil ca ei să-și cunoască mijlocul, Marusi Churai. În dreapta, se uită la una dintre nave, de la conducerea conducerii lui Kozak.
Trimiteți-le prietenilor: