O legătură chimică este înțeleasă ca diferitele tipuri de interacțiuni care determină existența stabilă a compușilor doi și policatomi: molecule, ioni și substanțe cristaline. Prin natura sa, legătura chimică este interacțiunea dintre nucleele încărcate pozitiv și electronii încărcați negativ și, de asemenea, electronii unul cu celălalt. Principalele tipuri de legături chimice: metalice covalente, ionice. Pentru a descrie legătura covalentă, se folosesc două metode: metoda legăturii de valență (MVS) și metoda orbitalelor moleculare (IMO).
Baza metodei BC este următoarea:
1. În formarea unei legături covalente, numai electronii neparticipați ai doi atomi cu spinuri direcționate opus (mecanismul de schimb al formării legăturii) participă sau o pereche de electroni de un atom
- donator și orbital liber al altui atom acceptor (mecanism donor-acceptor).
2. O legătură chimică covalentă între doi atomi apare ca urmare a suprapunerii orbitalilor atomici cu formarea perechilor de electroni (socializarea a doi electroni).
Conform teoriei legăturilor de valență, legătura covalentă este îndreptată spre suprapunerea maximă a orbitalilor atomici ai atomilor care interacționează.
Structura geometrică (spațială) a unei molecule constând din mai mult de doi atomi se datorează aranjamentului reciproc al orbitalilor atomici implicați în formarea legăturilor chimice. Molecula AB2 poate fi liniară. sau structura unghiulară (a). Molecula AB3 poate lua forma unui triunghi obișnuit (b), a unei piramide trigonale (c). Molecula AB4 este forma tetraedrului (d).
Structura spațială a moleculei este determinată de tipul de hibridizare a orbitalilor de valență ai atomului central și de numărul de perechi de electroni care nu sunt împărțite în stratul electronic de valență.
Exemplul 1. Descrie structura moleculelor din poziția metodei de legare de valență: a) PH3. b) BBr3. Ce orbite atomice sunt implicate în formarea legăturilor chimice? Specificați tipul de hibridizare (dacă are loc hibridizarea). Care este structura spațială a acestor molecule?
Soluția. a) Formarea moleculei PH3.
Vom scrie formulele electronice ale atomilor care formează molecula PH3 în starea de bază (normală): 15 P 1s 2 2s 2 2p 6 3s 2 3p 3; 1 N 1s 1
Formule electronice-grafice pentru nivelul extern al acestor atomi:
În această moleculă, atomul central este un atom de fosfor, în care formarea trei legături chimice implicate numai p - orbitalii dispus pe un substrat și având aceeași formă și aceeași energie. Prin urmare, nu există hibridizare în molecula PH3.
Pentru reprezentarea vizuală a circuitelor de valență se poate utiliza următoarea metodă. Electronii aflați pe stratul electronic exterior sunt desemnați de puncte situate în jurul simbolului chimic al atomului. Electronii obișnuiți pentru doi atomi sunt arătați prin puncte aflate între simbolurile lor chimice; O legătură dublă sau triplă este notată cu două sau trei perechi de puncte comune, respectiv. Aplicând aceste denumiri, formarea moleculei PH3 poate fi reprezentată după cum urmează:
Această schemă poate fi scrisă diferit: H - P - H, unde fiecare pereche de electroni care leagă doi atomi corespunde unei linii reprezentând o legătură covalentă în formulele structurale.
p - norii electronici ai atomului de fosfor sunt orientați în direcții reciproc perpendiculare (de-a lungul axelor de coordonate) -px. pv. pz și au o formă de dumbbell. La atomul de hidrogen în formarea legăturii chimice P-H este implicat s-electron, care are o formă sferică a norului. Atunci când se formează molecula PH3, norii de electroni ai atomului de fosfor se suprapun cu norii de electroni de trei atomi de hidrogen:
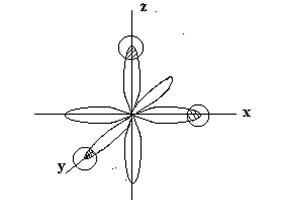
În conformitate cu cerințele metodei de valență, trei legături
P - H trebuie localizat la unghiuri apropiate de 90 ° C. În consecință, aranjamentul spațial al legăturilor simple determină structura geometrică a moleculei. Molecula PH3 trebuie să aibă forma unei piramide trigonale:
În partea de sus a piramidei există un atom de fosfor, iar în partea de sus a bazei sunt atomi de hidrogen.
b) Formarea moleculei BBr3. În molecula BBr3, atomul central este un atom de bor.
Formule electronice de atomi:
5 V 1s 2 2s 2 2p 1 35 Br 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 5
Formulele electronice-grafice de nivel extern au forma:
Deoarece borul din compus este trivalent, notăm formula electronică-grafică a atomului de bor în stare excitată:
În formarea a trei legături chimice în molecula BBr3, participă un s- și doi p-orbitali, localizați pe diferite subsoluri și posedând diferite forme și diferite energii:
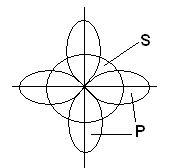
În acest caz, în locul celor originale s și două p-orbitale ale atomului de bor excitat, se formează trei orbite hibride echivalente (sp2 este hibridizarea). Când hibridizarea sp2, norii hibrizi de electroni sunt localizați în direcții situate în același plan și orientate la unghiuri de 120 ° unele față de altele:
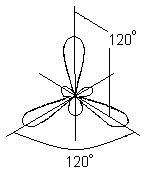
Acest tip de hibridizare corespunde formării unei molecule plane triunghiulare. În formarea moleculei BBr3, trei orbite hibride ale atomului de bor se suprapun cu orbitele p-electron ale a trei atomi de brom:
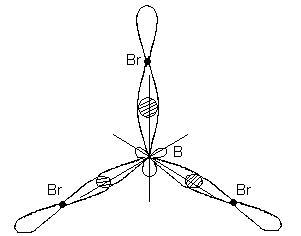
Molecul BBr3 are forma unui triunghi plat plat, în centrul căruia este un atom de bor și la atomii de vârf - brom. Toate cele trei legături ale B-Br din molecula BBr3 sunt echivalente.
Exemplul 2. Desenează diagramele energetice pentru formarea moleculei F2 și a ionului molecular F2 + prin metoda orbitalilor moleculari. Câți electroni sunt pe orbitele obligatorii și slăbite? Care este ordinea de comunicare în aceste particule? Specificați caracteristicile lor magnetice (paramagnetism sau diamagnetism).
Soluția. Conform teoriei orbitalilor moleculare (IMO) molecula este considerată ca o colecție de nuclee încărcate pozitiv și electroni încărcați negativ, fiecare electron se mișcă în cealaltă a electronilor și nucleelor tuturor.
Pentru a descrie o moleculă conform teoriei MMO înseamnă a determina tipul orbitalilor săi, energiile lor și pentru a clarifica natura distribuției electronilor asupra orbitalilor.
Atunci când se formează o moleculă, se formează orbitali moleculari de două tipuri - legarea și slăbirea. Dacă, în timpul formării unei molecule de la atomi, tranziția unui electron la o orbită moleculară va fi însoțită de o scădere a energiei, atunci o astfel de orbită moleculară este una obligatorie. Dacă tranziția unui electron la o orbită moleculară este însoțită de o creștere a energiei, atunci o astfel de orbită moleculară se va dezintegra.
Electronii din molecule sunt localizați pe orbitele s- și p-moleculare. S-orbitele pot fi formate prin suprapunerea orbitalilor s-atomi și suprapunerea orbitalilor atomici de 2px. În acest caz, se formează orbitale moleculare: legarea s (ssv) și s-dezintegrarea (ssr). Când se suprapun orbali atomici 2p și 2pz, se formează orbitale moleculare: pc2Py. pcv2Pz și p-2Py. praz2Rz. Ordinea plasării electronilor de-a lungul orbitalilor moleculari este aceeași ca și în cazul orbitalilor atomici, adică corespunde principiului celui mai puțină energie, principiul Pauli, regula Hund.
Articole similare
Trimiteți-le prietenilor: