Ce forțe dețin într-adevăr atomii din moleculă unul lângă celălalt, dacă pentru descompunerea moleculei în atomi neutri este necesar să se încălzească gazul la aproximativ 4000 K? Care sunt principalele probleme cu care ne confruntăm atunci când încercăm să găsim un răspuns la această întrebare, care îngrijorează chimistii din întreaga lume până în prezent?
Să analizăm aceste probleme în detaliu. Bazat reprezentări de contact formulate ale structurii atomice poate fi modelul extrem de simplu propus molecula de hidrogen - doi protoni (una pentru fiecare nucleu) și doi electroni (Figura 1.).
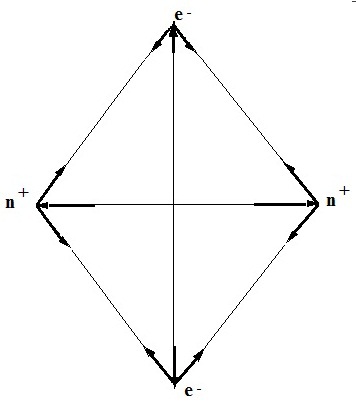
Figura 1. Un model simplu al unei molecule de hidrogen
În conformitate cu acest model, nucleele încărcate pozitiv atrag electroni care se află în câmpul de acțiune al ambelor nuclee. Simultan, forțele repulsive dintre particulele încărcate de același nume acționează. Se știe din experimente că atunci când se formează energie, energia este eliberată. Astfel, dacă se formează o legătură, atunci, forțele de atracție din moleculă trebuie să prevaleze asupra forțelor respingătoare.
Cu toate acestea, calculele efectuate pe baza unei determinare experimentală a parametrilor, cum ar fi potențialul de ionizare, afinitatea de electroni (energia eliberată atunci când un electron care unește atomul neutru), lungimea (distanța dintre centrele atomilor care interacționează), sunt în contrast puternic cu acest sistem simplu. Deoarece afinitatea electronului atomului de hidrogen (FE) este egală cu 72 kJ / mol, energia pentru a depăși forțele de atracție a electronilor nu trebuie să depășească, adică nuclee 2SE 144 kJ / mol. Cu toate acestea, în scopul de a distruge molecula de hidrogen, este necesar să se consume energie egală cu 432 kJ / mol. Aceste discrepanțe între calcul și experiment vor fi de fapt și mai mari dacă luăm în considerare forțele repulsive dintre nuclee.
Din măsurătorile razei covalente este cunoscut faptul că distanța dintre cele doua nuclee din molecula de hidrogen este 0,068 nm. Având în vedere această distanță nuclei forță de respingere (Coulomb interacțiune) se ridică la 1877 kJ / mol. Atunci când formează o moleculă de hidrogen, aceste forțe respingătoare trebuie depășite. Conform teoremei viriale, energia necesară pentru distrugerea moleculei de hidrogen trebuie să fie egală cu jumătate din energia potențială, adică 1877: 2 ≈ 939 kJ / mol. Astfel, formarea hidrogenului molecule câștig de energie va fi 939 + 432 = 1371 kJ / mol, în timp ce modelul (vezi. Fig.1), rezultă că câștigul de energie maximă este egală cu 144 kJ / mol, care este de numai 10,5% din experimentele găsite. Astfel, se poate concluziona că, conform acestui model, legătura chimică în molecula de hidrogen nu poate fi formată. Din nou nu am primit un răspuns la întrebarea: Ce forțe dețin atomii într-o moleculă?
Se produc contradicții grave atunci când se încearcă găsirea răspunsului la următoarea întrebare: Cum se transferă energia corespunzătoare ruperii legăturii în moleculă?
După cum sa menționat deja, pentru a rupe legătura chimică, trebuie să comunicați energia sistemului. Presupunând că energia de legare este comparabilă cu energia electronilor, ar trebui să ne așteptăm schimbări în energia lor, ca atunci când o moleculă și la distrugerea ei. Chiar și o astfel de explicație simplă este în contradicție cu datele experimentale.
Energia de legare determinată experimental într-o moleculă de hidrogen este de 432 kJ / mol. În consecință, atunci când conexiunea este ruptă, adică în detrimentul unei astfel de cantități de energie, energia electronilor din atomi ar trebui să crească cu 432 kJ / mol. Cu toate acestea, în conformitate cu datele spectrale ale atomilor, electronii pot absorbi o porțiune de energie de numai mai mult de 1000 kJ / mol (
166. 10-23 kJ / electron). În plus, unele fapte experimentale, nu numai că nu obține o explicație în cadrul modelului electrostatic, dar, de asemenea, să fie cu ea în contrast puternic. De exemplu, o legătură chimică, ca regulă, este formată cu participarea a doi electroni. Dacă electronii se combină într-adevăr, de ce întotdeauna 2 (nu 1 și nu 3)? Mai mult, caracteristicile electrostatice ale tuturor atomilor (IPP, electronegativitate, afinitate de electroni) crește pe perioada de la stânga la dreapta (adică, din primul grup din tabelul periodic), în timp ce dependența energia M-M (unde M - orice membru) din primul potențialul de ionizare, găsit experimental, trece prin maxim în aceeași direcție. Valoarea maximă a vârfului parabolei, de regulă, cade pe mijlocul perioadei. În același timp, lungimea conexiunii în timpul perioadei scade.
Problema naturii legăturii chimice rămâne deschisă nu numai din punctul de vedere al chimiei, ci și din punctul de vedere al fizicii, precum și din cauza prezenței unei anumite forțe terțe.
Trimiteți-le prietenilor: