Comanda 320405 3 varianta 11 sarcini
separat în dosar: 3 203
Ce este electronegativitatea? Cum se schimbă electronegativitatea elementelor p în perioada și în grupul sistemului periodic cu numărul ordinal în creștere? De ce?
electronegativitate
Electronegativitatea (EO) a unui atom este abilitatea unui atom dintr-o moleculă (un compus) de a atrage electroni care îl leagă de alți atomi.
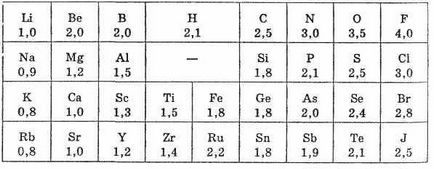
Conceptul de electronegativitate a fost introdus de L. Pauling (SUA, 1932). Caracterizarea cantitativă a electronegativitatea atomului este foarte condiționată și nu poate fi exprimată în termeni de cantități fizice, prin urmare, pentru determinarea cantitativă a EO oferit mai multe scale. Scala EE relativă, dezvoltată de L. Pauling (vezi Tabelul 1), a primit cea mai mare recunoaștere și diseminare.
Conform scalei L. Pauling, fluorul EO (cel mai electronegativ al tuturor elementelor) este luat în mod condiționat egal cu 4,0; În al doilea rând, există oxigen, în al treilea rând - azot și clor. Hidrogenul și nemetalele tipice se află în centrul scalei; valorile EO ale acestora se apropie de 2.
Cele mai multe metale au valori EO de aproximativ 1,7 sau mai puțin. Observăm că EO este o cantitate fără dimensiuni.
Tabelul 1. Valorile electronegativității elementelor de către Pauling
Relația dintre diferența de electronegativitate și gradul de ionicitate al legăturii

Nu este greu să găsești o regularitate interesantă - scara Pauling, în termeni generali, seamănă cu un sistem periodic de elemente. Această scală permite estimarea gradului de ionicitate (polaritate) a legăturii. Pentru a face acest lucru, folosiți relația dintre diferența dintre EO și gradul de ionicitate al legăturii (tabelul 2).
Din tabel. 2 rezultă că cu cât este mai mare diferența în EO, cu atât este mai mare gradul de ionicitate. Diferența de EO, egală cu 1,7, corespunde naturii ionice de 50% a legăturilor, astfel încât legăturile cu diferența de EO mai mare de 1,7 pot fi considerate ionice. Legăturile cu o diferență mai mică sunt denumite polar covalent.
Pentru a cuantifica caracteristicile propuse ca măsură a electronegativitatea de energie egală cu suma aritmetică a energiei de ionizare (D) și afinitatea de electroni (E), r. F.
unde X este electronegativitatea atomului și deci a elementului.
De exemplu, definim X pentru fluor și litiu. Din tabelele de căutare descoperim că IF = 17,42 eV, EF = 3,62 eV, ILI = 5,39 eV, ELi = eV 0,22 (calculat indirect).
Apoi, XF = 17,42 + 3,62 = 21,04 eV și XLi = 5,39 ± 0,22 = 5,61 eV.
Fluorura are cea mai mare valoare a lui I + E, deci este cel mai electronegativ element. Cea mai mică valoare a electronegativității are atomi de metale alcaline.
De obicei, electronegativitatea litiului este luată ca unitate, iar electronegativitatea altor elemente este comparată cu ea. Apoi, obținem valori simple și convenabile pentru comparație în raport cu electronegativitatea elementelor (indicăm cu x):
xLi = 1; xF = 21,04 / 5,61 "4 și așa mai departe.
În prezent, un tabel de electronegativități relative este folosit pe scară largă, iar cele mai recente date despre structura electronică a atomilor și raza lor sunt folosite în compilație.
Trebuie remarcat faptul că valorile relative ale electronegativității prezentate în diferite cărți despre chimie diferă oarecum. Acest lucru se datorează faptului că acestea au fost calculate prin metode diferite bazate pe anumite ipoteze și ipoteze.
K p - unitate sunt 30 elemente IIIA-VIIIA a sistemului periodic și include mici perioade doua și a treia și a patra - a șasea perioade lungi.
Pentru elementele grupului IIIA, primul electron apare pe orbitele p. În celelalte grupuri IVA-VIIIA, o umplere consecutivă a lui p-sublevel are loc până la 6 electroni. Structura cojilor de electroni externi ai atomilor elementelor p-blocului ns2npa. unde a = 1 ÷ 6.
În perioadele din stânga, atomice și ionice raze r - elemente cu creșterea de încărcare a nucleului scade, energia de ionizare și afinitatea de electroni, în creștere generală, elektrootritsatelnostuvelichivaetsya. se intensifică activitatea oxidativă a substanțelor simple și a proprietăților nemetalice.
În această perioadă, electronegativitatea crește odată cu creșterea numărului ordinal al elementului (de la stânga la dreapta), dar în grup. De regulă, acesta scade, deoarece încărcătura nucleului crește (de sus în jos).
Strict vorbind, elementului nu i se poate atribui o electronegativitate constantă. atom Electronegativitate depinde de mulți factori, în special cu privire la starea de valență a atomului, starea de oxidare formală a numărului de coordonare, natura ligandului care constituie mediul atomului într-un sistem molecular, și de către unii pe alții.
In ultimii ani, din ce în ce pentru a caracteriza electronegativitatea folosind așa-numitul electronegativitatea orbital, în funcție de tipul de orbitali atomici implicate în formarea de legături, iar pe de e-populație, adică. E. Pe ocupat orbitali atomici pereche de electroni neîmpărtășită, o dată locuită de nepereche electron sau este vacant.
Dar, în ciuda cunoscute dificultăți în interpretarea și definirea electronegativitate, este întotdeauna necesar pentru o descriere calitativă și predicție a naturii relațiilor în sistemul moleculare, inclusiv energia de legare a distribuției de încărcare de electroni și ionicity, constanta forță, și așa mai departe. D.
Astfel, elementele s din grupa 1 și cele mai mari elemente p din grupele 6 și 7 au cea mai mică electronegativitate.
Numărul sarcinii 23
Calculați efectul termic al reacției de reducere a oxidului de fier (II) cu hidrogen. pe baza următoarelor ecuații termodinamice:
FeO (k) + CO (g) = Fe (k) + C02 (g) # 916; H = -13,18 kJ
CO (g) + 1/2 O2 = CO2 (g) # 916; H = -283,0 kJ
H2 (g) + 1/2 O2 = H20 (g) # 916; H = -241,83 kJ
1. Efectul termic al reacției este același cu diferența dintre sumele încălzirii formării produselor și a reactivilor, luând în considerare coeficienții stoichiometrici din ecuație.
Căldură obrazovaniyalyubogo substanță numită reacții efect termic care formează 1 mol dintr-un compus simplu, t. K. Valoarea absolută a entalpiei nu poate fi măsurat, termochimic substanțelor simple de generare de căldură convențional este setat la 0 ° C.
Pentru a se asigura că toate efectele termice pot fi comparate, toate substanțele sunt luate în starea standard (selectată).
Gazul este o stare cu P = 105 Pa
Solidul este starea, cea mai stabilă modificare cristalografică. (C este diamantul de grafit).
Concentrația lichidului este C = 1 mol / l
Încălzile de formare a substanțelor sunt date în cărțile de referință.
Ecuația reacție definirea stării de agregare sau modificării cristaline in jurul caractere compusi chimici precum valoarea efectelor termice se numește termochimic.
Pentru a calcula efectul termic al reacției de reducere a oxidului de fier (II) cu hidrogen,
Folosim efectul legii Hess și efectele termice ale reacțiilor date, luând căldură de formare a substanțelor simple în 0.
Din reacție
H2 (g) + 1/2 O2 = H20 (g) # 916; H = -241,83 kJ
Din reacție
Numărul sarcinii 63
Reacția se efectuează conform ecuației N2 + 02 = 2NO. Concentrațiile materiilor prime înainte de începerea reacției au fost: [N2] = 0,049 mol / l; [O2] = 0,01 mol / l. calculați concentrația acestor substanțe în acel moment. când [NO] = 0,005 mol / l.
Dependența ratei de reacție chimică la concentrația de substanțe reactive este determinată de legea maselor acționatoare (ZDM).
Conform vitezei de reacție ZDM care curge într-o singură etapă, la o temperatură constantă este proporțională cu produsul concentrațiilor molare de reactanți în grade, egal cu raporturile stoichiometrice.
În consecință, pentru reacție
Viteza reacției directe
unde v este rata de reacție
k este un coeficient de proporționalitate, numit constanta de reacție
C (N2) și C (O2) sunt concentrațiile moleculare de azot și oxigen
Rata reacției inverse
Pentru a calcula concentrația reactanților, compilam un tabel pentru claritate și comoditate a calculelor
Sarcina nr. 000
Compuneți ecuații electronice și indicați ce proces - oxidare sau reducere - apare atunci când apar următoarele reacții:
As3-A5s + N3 + N3-S2-S0
Pe baza ecuațiilor electronice, aranjați coeficienții în ecuația reacției, urmând schema:
Reacțiile de oxidare-reducere sunt numite reacții însoțite de o modificare a gradului de oxidare a atomilor care alcătuiesc substanțele care reacționează.
Gradul de oxidare (n) se înțelege că reprezintă sarcina condițională a atomului, care se calculează pe baza presupunerii că molecula constă numai din ioni. Cu alte cuvinte: gradul de oxidare este sarcina condiționată care ar dobândi atomul elementului dacă se presupune că el a primit sau dat un anumit număr de electroni.
Oxidarea-reducere este un singur proces, interdependent. Oxidarea duce la o creștere a stării de oxidare a agentului reducător și reducerea la o scădere a oxidantului.
Creșterea sau descreșterea gradului de oxidare a atomilor se reflectă în ecuațiile electronice: oxidantul primește electroni, iar agentul reducător le dă înapoi.
Nu contează dacă electronii trec de la un atom la altul și se formează legături electronice sau electronii sunt atrași doar la un atom mai electronegativ și apare o legătură polară.
Capacitatea unei substanțe de a-și expune proprietățile oxidante, de reducere sau de dublă (atât oxidante cât și de reducere) poate fi judecată de starea de oxidare a atomilor de oxidant și de agent de reducere.
Atomul acestui sau acelui element în cel mai înalt grad de oxidare nu-l poate mări (renunțe la electroni) și nu are decât proprietăți oxidante. și la cel mai mic grad de oxidare nu-l poate reduce (ia electroni) și arată doar proprietăți de restaurare. Atomul elementului, care are un grad intermediar de oxidare. pot prezenta atât proprietăți oxidante, cât și proprietăți de reducere.
1. Vom compune ecuațiile electronice și vom indica ce proces - oxidare sau reducere - apare în următoarele reacții:
procesul de oxidare. unde atomul de arsen As3- cu gradul de oxidare -3 (cel mai mic grad de oxidare pentru arsen) este un agent reducător.
procesul de recuperare. unde atomul de azot N3 + cu o stare de oxidare de +3 (o stare de oxidare intermediară pentru azot) este un agent de oxidare.
procesul de oxidare. unde atomul de sulf S2 - cu gradul de oxidare -2 (cel mai mic grad de oxidare pentru sulf) este un agent reducător.
2. Pe baza ecuațiilor electronice, aranjăm coeficienții în ecuația procesului de reacție conform schemei:
S + 4-2e = S + 6 || 3 - un agent reducător
Mn + 7 + 3e = Mn + 4 || 2 - oxidant
Luând în considerare ecuațiile electronice și legea conservării masei, aranjăm coeficienții în eq.
3Na2S03 + 2KMnO4 + H2O = 3Na2S04 + 2Mn02 + 2KOH
Sarcina nr. 000
La ce concentrație de Zn2 + (în mol / l) potențialul electrodului de zinc va fi de 0,015 V sub potențialul său electrod standard?
Dacă placa metalică este coborâtă în apă, cationii metalici de pe suprafața ei sunt hidratați de moleculele polare de apă și trec într-un lichid. În acest caz, electronii, care rămân în exces în metal, își încarcă negativ stratul de suprafață. Există o atracție electrostatică între cationii hidrați și suprafața metalului care a trecut în lichid. Ca urmare, în sistem se stabilește un echilibru mobil:
în soluție pe metal
unde n este numărul de electroni care participă la proces.
La limita metal-lichid, apare un strat dublu electric, caracterizat printr-un salt potențial definit - potențialul electrodului.
Valorile absolute ale potențialului electrodului nu pot fi măsurate.
Potențele electrodului depind de un număr de factori (natura metalului, concentrația, temperatura etc.). Prin urmare, determină de obicei potențialul relativ de electrod în anumite condiții - așa-numitele potențiale electrod standard (E0).
Potențialul de electrod standard al metalului se numește potențialul său electrod dezvoltat prin imersarea metalului într-o soluție de proprii ioni cu concentrația (sau activitatea) de 1 mol / dm3, măsurată în raport cu un electrod standard de hidrogen, potențialul care la 250C este luată în mod convențional ca zero (E0 = 0 ; # 916; G0 = 0).
Prin aranjarea metalelor într-o serie ca potențialul lor de electrod standard (E0) crește, obținem așa-numitele serii de solicitări.
Poziția unui metal într-o serie de tensiuni caracterizează capacitatea sa de reducere, precum și proprietățile oxidante ale ionilor săi în soluții apoase în condiții standard.
Mai mică valoarea E0, mai mare are rezistența de metal activă ca substanță simplă și mai mică oxidative capacității exponatul ionii săi, și vice-versa.
Potențele electrodului sunt măsurate în dispozitive numite celule galvanice.
Reacția redox care caracterizează funcționarea celulei curge în direcția în care celula forța electromotoare are o valoare pozitivă. În acest caz # 916; G0 <0, так как
Potențialul electrodului metalic (E) depinde de concentrația ionilor săi în soluție. Această dependență este exprimată prin ecuația Nernst:
unde este potențialul electrodului standard;
n este numărul de electroni care participă la proces;
- Concentrația (cu calcule precise - activitate) a ionilor metalici hidrați în soluție, mol / dm3;
Definiți la ce concentrațiile de Zn2 + (în mol / l), potențialul electrodului de zinc va fi mai mică decât 0,015V său potențial de utilizare electrod standard pentru care ecuația Nernst:
0059 * lg [Zn2 +] / n = E (Zn2 + / Zn) - E0 (Zn2 + / Zn)
lg [Zn2 +] = 0,015 * 2 / 0,059 = 0,5
Sarcina nr. 000
În timpul electrolizei unei soluții de CuSO4 la anod, a fost eliberat 168 cm3 (n.a.) de gaz. Compuneți ecuațiile electronice ale proceselor care apar pe electrozii și calculați cât de mult este eliberat cuprul la catod.
Trimiteți-le prietenilor: