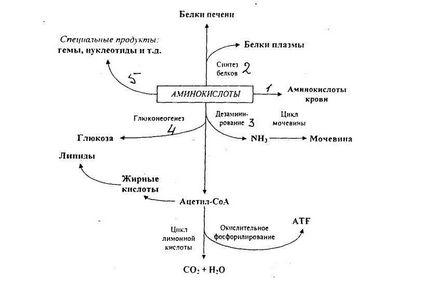
Există cinci moduri:
- transportul către alte țesuturi;
Aminoacizii din ficat pot intra în sistemul circulator și, prin urmare, pot fi furnizați altor organe și pot fi utilizați și ca proteine structurale pentru biosinteza proteinelor tisulare.
- biosinteza proteinelor hepatice și a plasmei sanguine;
Proteinele hepatice sunt actualizate în mod constant și se caracterizează printr-o rată de fluctuație foarte mare, cu un timp mediu de înjumătățire de doar câteva zile. În plus, în ficat se sintetizează mai multe proteine plasmatice.
-dezasamblare și dezintegrare;
Aminoacizii care nu au fost utilizate în ficat și suferă dizaminirovaniyu se descompun pentru a forma acetil-CoA și substraturi intermediare de acid citric, acesta din urmă poate fi transformată în glucoză și glicogen prin glyukoneogineza. Acetil-CoA sau suferă oxidare în ciclul acidului citric, acumularea de energie stocată sub formă de ATP, fie transformate in lipide care sunt depozitate în stoc. Aminoacizii și amoniacul eliberați după descompunere sunt transformați în uree, în timpul ciclului ureei în ficat.
Ficatul este, de asemenea, implicat în metabolismul aminoacizilor care vin, din când în când, din țesuturile periferice. La câteva ore după fiecare masă, alanina intră în ficat din mușchi. În ficat, este supus dezinfecției, iar piruvatul rezultat, ca rezultat al gluconeoginozelor, se transformă în glucoză din sânge. Glucoza se întoarce în scheletul mușchilor pentru a le umple cu o rezervă de glicogen. Una dintre funcțiile schimbului ciclic este aceea că este atenuată de fluctuația nivelului glucozei din sânge în perioadele dintre mese. Creșterea în mușchi a deficitului, în viitor, după masă este suplimentată de absorbția aminoacizilor din alimente.
-conversia în nucleotide și alte produse.
Aminoacizii servi ca precursori în biosinteza bazelor purinice și pirimidinice, nucleotide, precum și în sinteza anumitor substanțe specifice, în special porfirinelor, hormoni și alți compuși care conțin azot.
Proteinele leagă apa, adică prezintă proprietăți hidrofile, în timp ce se umflă, crește masa și volumul lor. Umflarea proteinei este însoțită de dizolvarea sa parțială. Hidrofilicitatea proteinelor individuale depinde de structura lor.
Datorită prezenței pe suprafața globulelor de proteine, grupuri care poartă o sarcină pozitivă sau negativă se formează în jurul învelișului hidratul molecula de proteine, care împiedică agregarea și contribuie astfel la stabilitatea soluției de proteină și pentru a preveni precipitarea lor. În IET, proteinele au cea mai mică capacitate de a lega
apa, există o distrugere a coajă hidrat, astfel încât agregatele mari de molecule de proteine sunt convertite. Agregarea proteinei are loc și cu deshidratarea cu ajutorul unor solvenți organici. Când pH-ul mediuului se schimbă, macromolaculul proteinei devine încărcat și modificările sale de hidrotalență. Cu edeme limitate, soluțiile concentrate de proteine formează sisteme complexe numite jeleu. Ei nu au fluiditate, sunt elastici, sunt din plastic, au o anumită rezistență mecanică și își pot menține forma. Proteinele globulare pot fi complet hidratate prin dizolvarea în apă, formând soluții cu concentrație scăzută, de exemplu proteinele din lapte. Proprietățile hidrofobice ale proteinelor, adică, capacitatea lor de a se umfla pentru a forma jeleuri, stabilizând emulsii, suspensii și spume, are o mare importanță în biologie și depozitarea alimentelor și prelucrarea cerealelor. pâine de coacere, producția de paste etc., diversitatea hidrofilică a proteinelor este unul dintre cele mai importante semne ale grâului puternic și slab. Motivul puternic hidratat este glutenul brut, izolat din aluat de grâu. Conține până la 65% apă. Diferitele hidrofilități ale proteinelor de gluten reprezintă una din caracteristicile care caracterizează calitatea boabelor și a făinii obținute din acestea.
Denaturarea Belkov- este un proces complex, în care, sub influența factorilor externi modifică fișierul binar, structura terțiară și cuaternară a moleculei de proteină, adică structura sa spațială nativă. Structura primară și, prin urmare, compoziția chimică a fasciculului nu se modifică. Denaturarea modifică proprietățile originale ale substanțelor proteice. Acest lucru crește reactivitatea anumitor grupări chimice în moleculă, poyaplyayutsya grup liber (sulfhidril și colab.), Solubilitate redusă, hidrofilicitatea, activitatea enzimatică, se schimbă forma sau cantitatea moleculei de proteină, creșterile sale de asimetrie, facilitate de expunerea la proteolitice enzime, proteine, și prin urmare, este mai ușor să se hidrolizeze. În tehnologia alimentară, denaturarea termică a proteinelor este de o importanță practică deosebită. Încălzirea provoacă descompunerea legăturilor de hidrogen și perturbe interacțiunea grupurilor hidrofobe. Denaturarea termică a proteinelor se observă cel mai adesea atunci când se usucă cerealele, dacă se desfășoară în încălcarea normelor stabilite și, de asemenea, ca rezultat al auto-încălzirii.
Când se încălzește la capacitatea de germinare a cerealelor nu se schimbă. La o temperatură, proprietățile de coacere scad, în special boabele de grâu. Gradul de denaturare termică depinde de temperatură, de durata încălzirii și de umiditate. Acest lucru trebuie amintit atunci când se dezvoltă regimuri de tratament termic pentru materii prime alimentare, produse semifabricate și, uneori, produse finite. Un rol deosebit în procesul de denaturare termică are rolul de a blânge materialul vegetal, de a coace pâinea și de a obține paste făinoase. Metodele de denaturare fizică, chimică și biologică sunt utilizate pe scară largă în industria alimentară și în biotehnologie.
Acest proces este înțeles ca capacitatea proteinelor de a forma sisteme cu un grad ridicat de moleculare: gaz lichid. Astfel de sisteme sunt numite - spumă. Stabilitatea spumei în care proteina este un agent de spumare depinde nu numai de natura sa, ci și de concentrația și temperatura. Proteinele de agenți de spumare sunt utilizate pe scară largă în industria de cofetărie în producția de pastile, marshmallows. Ele joacă un rol important în formarea rezistenței la spumă și spumă în berea finită. Structura spumei are pâine și aceasta afectează proprietățile sale organoleptice. Pâinea bună are o structură de spumă înghețată. Soluțiile de proteine arată o capacitate maximă de spumare, de regulă, în IET, obținută în medii slab acide. Pentru a produce masele de cofetărie spumoase ca stabilizatori de spumă, au fost utilizate pe scară largă albușuri de ou și spumă de proteine din lapte. La prepararea pastilelor, se adaugă un alb proaspăt de ou într-o cantitate de 1,5% față de greutatea amestecului de zahăr-bloc. La același pH = 3,2-3,8. proteinele din lapte în medii puternic acide reduc capacitatea de spumare, astfel încât acestea sunt utilizate numai în fabricarea mai multor mase dulci de cofetărie. Pe lângă acestea, alte proprietăți tehnologice ale proteinelor sunt importante, de exemplu, acestea fiind folosite ca materiale de umplutură pentru diverse băuturi, inclusiv băuturi carbogazoase. Băuturile îmbogățite cu hidrolizate de proteine, de exemplu soia, au un conținut scăzut de calorii și pot fi stocate pentru o lungă perioadă de timp chiar și la temperaturi relativ ridicate fără adăugarea de conservanți.
Alergiile alimentare joacă un rol negativ pentru om, exprimată în reacții nedorite dureroase (inflamație, roșeață și mâncărimi ale pielii, dificultăți de respirație, etc.), ca răspuns la aportul de proteine al unuia sau mai multor alimente (cel mai frecvent căpșuni, lapte, ouă). Alergiile sunt rezultatul sensibilității sporite a unei persoane la o anumită substanță (alergen) ca urmare a contactului anterior cu această substanță. Când celulele străine sau moleculele de proteine (antigene) intră în sânge, se formează anticorpi împotriva lor. Cu toate acestea, într-o serie de cazuri, când o persoană intră mai întâi în sânge, se formează așa-numiți anticorpi reactivi, care sunt prezenți nu numai în serul de sânge. Dar, de asemenea, situat pe suprafața unui număr de celule foarte reactive, atât în sânge, cât și în unele țesuturi. Reacțiile acestor organisme secundare primite de antigen din sânge însoțite de modificări în structura și metabolismul în aceste celule, în timp ce ele formeaza substante foarte active care sunt eliberate in sange si conduce la dezvoltarea de alergii clinice. Alimentele alergice pot fi cauzate nu numai de proteinele alimentare, care sunt antigene pentru corpul uman, dar și de compușii neobișnuiți cu molecule scăzute care intră în alimentație. Ei se alătură propriilor proteine în corpul uman și le transformă în proteine străine, care determină răspunsuri imune în mai multe cazuri de natură alergică. Conectarea compușilor neobișnuiți cu molecule joase care intră în hrană și din ea în sânge către propriile proteine ale corpului uman are loc în ficat. Prevenirea și tratamentul alergiilor alimentare este de a exclude alimentele intolerabile din dieta zilnică.
15. Insuficiență congenitală a metabolismului aminoacid la om.
Fenilcetonuria. Baza acestei tulburări este mutația genei care codifică enzima, care este implicată în transformarea fenilalaninei. La o persoană sănătoasă, sub influența oxigenului în aer, fenilalanina este transformată în tirozină.
Fenilalanină + NADH + O tirozină + NAD + H0
Cu diferențierea ereditară, transformarea are loc pe o cale diferită pentru a forma fenilpiruvat. Excesul de fenilpiruvat în sângele nou-născuților perturbă dezvoltarea normală a creierului și este cauza întârzierii mentale. Cu detectarea precoce, puteți crea condiții pentru dezvoltarea normală a copilului prin excluderea produselor fenilalaninei.
Reacția de formare a fenilpiruvatului:
Articole similare
Trimiteți-le prietenilor: