Membrana exterioară a celulei - "pielea" universală a celulei - îndeplinește funcțiile de transfer de nutrienți, apă și ioni și servește ca un transmițător de influențe neurohumorale asupra celulei. Membrana are un aparat receptor perfect. Este capabil să distingă moleculele individuale și ionii de substanțe, să le lase sau să construiască o barieră insurmontabilă în calea lor.
Conform modelului general acceptat de Danielli-Davson, membrana constă din straturi fosfolipide hidrofile și hidrofobe. Deasupra stratului fosfolipidic exterior se află un strat supramembranar format din glicoproteine încărcate negativ. Glicoproteinele leagă cationii spațiului extracelular - Ca2 + și Mg2 +, care joacă un rol important în reglarea curenților membranare și a activității fiziologice a celulei. Din interior, membrana plasmatică nu este îmbinată cu un strat proteic, sub-membranar. Astfel, membrana celulară cu o grosime submicroscopică (10-20 nm) are o structură complexă, în trei straturi (Figura 1). Noile date sugerează că complexele proteice nu sunt întinse pe suprafața straturilor fosfolipide, ci sunt înglobate în ele în forma globulară.

Fig. 1. Modele ale structurii moleculare a membranelor biologice: A - E - structuri lipidice în două straturi: proteină A în forma p; B-a-helix; B - proteină globulară; D - asimetrie în localizarea proteinei; D - tubulii și porii care penetrează straturile proteice; E este o proteină în interiorul unui strat dublu de lipide. Ж - К - organizarea globulară: Ж - micelii lipidice cu a-proteină; Și - miceliile lipidice cu proteine globulare; 3, K - transformarea organizației globulare într-o organizație în două straturi (conform lui E. Roberts-su, V. Novinsky, F. Saes, 1973)
Complexitatea structurii membranei este o condiție necesară pentru realizarea numeroaselor funcții și pentru conservarea vieții celulare (transmiterea semnalelor din mediul extracelular în celulă, transportul substanțelor prin membrană). Semnalele din mediul extracelular sunt transferate în interiorul celulei prin modificarea formei (conformației) proteinelor intramembranare. Rolul comutării moleculare a semnalelor de la suprafață la interiorul celulei este de asemenea realizat de lipidele membranare.
Modificările conforme în membrană afectează procesele metabolice intracelulare printr-un lanț de emițătoare - substanțe biologic active sintetizate de glanda prostată, rinichi și alte organe. Acestea reglementează amploarea influenței hormonilor în funcție de nevoile actuale ale celulei.
Transferul substanțelor prin membranele celulare se efectuează pasiv (cu privire la gradientul de concentrație), fără consumul de energie și, în mod activ, cu consumul de energie (față de gradientul de concentrație). Transferul activ se efectuează cu ajutorul pompelor de ioni, cea mai importantă parte fiind enzimele membranelor celulare - ionofori.
În condiții de repaus fiziologic, pompa de ioni pompează ionii de Na + din celulă. Purtătorii de ioni de Na + sunt activați de acidul adenozin trifosforic (ATP). Aproximativ 20% din resursele energetice ale celulei sunt cheltuite pentru această lucrare.
Transferul activ duce la o acumulare selectivă a anumitor substanțe de către celule la concentrații foarte scăzute în lichidul tisular. Un exemplu clar al acestei selectivități este acumularea de iod de către glanda tiroidă: concentrația de iod în glanda tiroidă este de sute de ori mai mare decât conținutul său în mediu.
Cea mai importantă funcție a membranei celulare este participarea sa la formarea potențialului electric al celulei.
În starea de repaus relativ, potențialul extern pe întreaga membrană a celulei este același. Cu toate acestea, datorită permeabilității diferite a membranei pentru ionii Na + și K +, diferența dintre potențiale este formată între părțile exterioare și interioare ale membranei. Na + ionii sunt îndepărtați continuu din celulă utilizând o pompă de potasiu-sodiu. În același timp, difuzează în celulă.
ionii K + în condiții de latența fiziologic transferate din citoplasmă la suprafața membranei de gradient de concentrație (concentrația K + ionilor din interiorul celulei este de 140 mmol / l până la 5 mmol / l la suprafața sa). Un exces de ioni pozitivi este creat pe suprafața exterioară a membranei. În interiorul celulei, dimpotrivă, un exces de molecule mari de anioni organici este pierdut, lipsit de orice legătură cu neutralizatorii lor, cationi K +.
Forme de activitate electrică
Distribuția neuniformă a ionilor între straturile interioare și exterioare ale membranei într-o celulă de odihnă determină o încărcare electrică constantă - un potențial de repaus. Valoarea sa variază între 50 și 100 mV. K + joacă rolul principal în menținerea potențialului de repaus. Formarea unui potențial de acțiune este dominată de ioni de Na +. Atunci când celula este iritată, schimbările fizico-chimice complexe au loc pe suprafața membranei celulare, ceea ce duce la o creștere a permeabilității sale pentru ionii Na +.
Trecerea ionilor Na + în celulă prin gradientul de concentrație conduce mai întâi la dispariția potențialului de repaus și, ulterior, la reversiune, schimbul de sarcină al membranei. K + fluxul de ioni din celula nu se poate schimba în mod substanțial rapid procesul de depolarizare funcționare, deoarece ionii Na + sunt capabili de a trece în excitația celulei este de 20 de ori mai rapid decât în starea de repaus, și excreția de K + ioni, dar crește exemplu, de 9 ori. Se crede că o creștere a permeabilității membranei pentru ionii Na + la excitație se datorează deschiderii canalelor în proteinele globulare înglobate în membrană. În membrana celulară polarizată, care este într-o stare de repaus fiziologic, porțile de canal de sodiu (așa-numitele rapid) sunt închise. Atunci când membrana este depolarizată, acestea sunt deschise. Înainte de debutul unui nivel critic de depolarizare, atât porțile rapide cât și cele lentă suportă un flux slab de ioni Na + din interior și ionii K + spre exterior.
Depolarizarea crește avalanșa: la începutul acțiunii stimulului, permeabilitatea ionică a membranei se modifică nesemnificativ. Fluxul de ioni K + din celulă depășește fluxul de ioni de Na + în acesta. Fluxul total de ioni este îndreptat spre exterior. Cu acțiunea continuă a stimulului, permeabilitatea membranei pentru ionii Na + crește. Fluxul de ioni total este direcționat în interiorul celulei. Din acest moment, potențialul local se dezvoltă într-un potențial de acțiune al valurilor (figura 3).
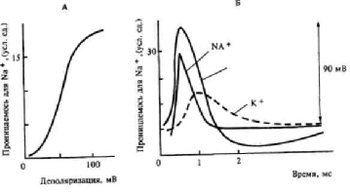
Figura 3. Fig. Mecanismul de apariție a potențialului de acțiune: A - creșterea permeabilității ionilor Na + și K *; B - transferul ionului prin membrană în timpul potențialului de acțiune
Potențialul de acțiune este un indicator informativ al activității vitale a celulei. Pentru unele organe, el a obținut parametri caracteristici având o valoare diagnostică (de exemplu, o electrocardiogramă a inimii). Teoria, explicând originea potențialelor electrice datorită re-pompării ionilor Na + și K + și modificărilor concentrației lor pe ambele părți ale membranei, se numește membrană. Există și alte concepte despre originea biocurenților (sorbția, teoria potențialului redox etc.). Cu toate acestea, până în prezent nu au decât interes istoric.
În cadrul teoriei membranei, se poate obține o explicație pentru schimbarea excitabilității în formarea unui val de excitație. Modificările locale ale activității electrice precede formarea undelor de excitație sunt rezultatul creșterii permeabilității membranei pentru ionii Na +. fluxuri Echilibrarea ioni de K + și Na + la stimulare păstra-schemsya înlocuit cu o creștere bruscă în permeabilitatea membranelor celulare pentru ionii de Na + (critic nivel de puncte tac depolarizare). Fluxul de ioni total se dovedește a fi direcționat în interiorul celulei.
Depolarizarea rapidă a membranei duce la o scădere a excitabilității. Fluxul de ioni de Na + din interiorul celulei la vârful potențialului de acțiune atinge un maxim și apoi scade brusc. În perioada de creștere rapidă și recesiune abruptă, potențialul de vârf este caracterizat de o non-excitabilitate totală (refractare absolută). Durata acestei faze în fibrele neurale este de aproximativ 0,004 s, în mușchiul inimii - până la 0,3 s.
Recuperarea initial aktivnos electrice whith celule (repolarizare) apare ca rezultat al inactivării de sodiu (pierderea permeabilității membranei celulare la sodiu) și K + accesoriu flux spre exterior. Repolarizarea merge mai întâi rapid și apoi este înlocuită cu procese lente (urmărire). Distingeți între potențialul negativ și pozitiv.
Începutul urmelor negativ potențial co-însoțită de recuperare incompletă a excitabilității - - refractară relativă, urmată de o fază de nor-mal și creșterea excitabilității - înălțare (Figura 4). Potențialul următor pozitiv, urmând negativul, este însoțit de o scădere a excitabilității la un nivel inferior celui inițial. Durata acestei scăderi coincide cu durata dezvoltării potențialului de urmărire pozitivă.
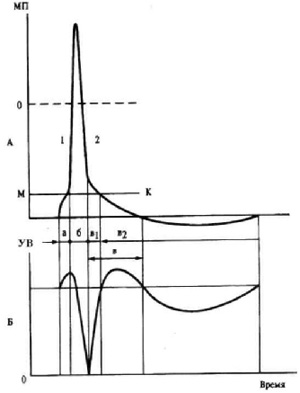
Fig. 4. Schimbarea excitabilității la diferite stadii de formare a undei de excitație: A - imagine schematică a undelor de excitație: 1 - depolarizare; 2 - repolarizare; MP - potențialul membranei; MK este nivelul critic al depolarizării; a este durata potențialului pragului; b - durata potențialului de acțiune; in - trace potențialul negativ. B - modificarea excitabilității: Vb - nivelul de excitabilitate în stare de repaus; a - creșterea excitabilității în timpul potențialului de prag; b - non-excitabilitate absolută; cr este relativ non-excitabilitate; c2 - excitabilitate crescută la sfârșitul potențialului negativ al traseului (conform NN Leontieva et al.)
Creșterea rapidă a permeabilității ionilor pentru Na + în timpul depolarizării se datorează descoperirii porților de sodiu rapide (activare). Inactivarea, adică o contracție puternică a fluxului de K + din celulă, datorită închiderii porții lente de potasiu. În urma potențialului de vârf, poarta rapidă se închide, cauzând încetarea aproape completă a fluxului de sodiu.
Creșterea excitabilității în faza potențialului negativ este o consecință a restaurării permeabilității membranei celulare pentru ionii Na +. Pe fondul excitabilității crescute, celula poate răspunde cu un alt impuls de excitație la acțiunile unui stimul slab.
Excitația pe termen lung este însoțită de o scădere a excitabilității ca rezultat al scăderii permeabilității sodice. În același timp, permeabilitatea membranei pentru ionii K + crește cu aceasta. Aceste schimbări în fluxurile de ioni duc la o scădere a excitabilității. Modificări similare în potențialul membranei se află în baza cazării - o creștere a sensibilității la prag cu acțiunea prelungită a stimulului.
Sfârșitul procesului de excitație și tranziția celulei la starea de dormit fiziologic este însoțită de includerea unei pompe de potasiu-sodiu care pompează ionii Na + din celulă, iar ionii K + în ea. Această activitate se desfășoară de fiecare dată cu cheltuielile de energie.
Modificarea excitabilității în timpul stimulării. Mișcarea fluxurilor de ioni prin membrana celulară determină modificarea excitabilității celulei, capacitatea acesteia de a răspunde la iritație. Pentru a provoca o schimbare a excitabilității, dezinfectantul trebuie să aibă o anumită putere. Forța minimă de stimulare, capabilă să provoace emoție, se numește excitat. Țesutul excitabil răspunde acțiunii stimulului de prag printr-o schimbare a activității electrice. La începutul acțiunii stimulului, aceste schimbări sunt de natură locală, non-val.
Potențialul local crește într-un potențial de valuri atunci când se atinge un nivel critic de depolarizare. Cu toate acestea, agenții subthreshold modifică de asemenea starea funcțională a țesuturilor excitabile. Dacă rezistența iritantului atinge 50-75% din prag, atunci țesutul viu răspunde la efectul său printr-o creștere nesemnificativă a excitabilității. Acesta este un răspuns local, non-electric. Nu se dezvoltă într-un potențial de acțiune.
Cu cât rezistența stimulului este mai mare, cu atât mai puțin timp este necesar pentru trecerea de la electronegativitatea locală la răspunsul la unde. Relația dintre puterea și durata stimulului a fost studiată la sfârșitul secolului al XIX-lea și începutul secolului al XX-lea. Forța minimă de stimulare la care are loc excitarea se numește reobaza.
Timpul necesar pentru a determina efectul excitației a fost numit timpul util. Pe măsură ce intensitatea stimulului crește, timpul în care se formează răspunsul la stimulare este redus. Timpul minim în care un curent de forță a două rebobe determină excitație se numește cronaxie. Relația dintre puterea stimulului și durata acțiunii sale are o formă aproape de o hiperbolă echilaterală.
Efectul curentului direct asupra țesuturilor conduce la o creștere a excitabilității sale sub catod (cathectron) și la scăderea sub anod (anelectroton).
Când DC excitabilitate acțiune prelungită sub anod este crescut, iar creșterea inițială în catod excitabilitatea se înlocuiește cu depresia ei (depresia cred Catholic). La baza acestor schimbări se află excitabilitatea protses-sy hiperpolarizarea membranei și depolarizare la anod sub catod. depresia catolică rezultă din inactivarea permeabilitatii de sodiu și creșterea transportului de K + ioni pe suprafața membranei celulare.
Articole similare
Trimiteți-le prietenilor: