Vorbind de un gaz ideal, am pornit de la ipoteza că moleculele nu interacționează unele cu altele. De fapt, aceasta presupune, desigur, lipsa energiei potențiale de interacțiune între ele. ciocniri elastice între moleculele și moleculele cu pereții trebuie să fie de cel puțin pentru că altfel nu va exista nici un mecanism prin care egală cu distribuția energiei a gradelor de libertate, altfel va fi imposibil să vorbim despre temperatura sistemului, presiunea de acolo, și m. molecule P. Coliziuni să se întâmple accidental. Acestea conduc la o schimbare în direcția și magnitudinea vitezei particulelor, dar nu se schimba distribuția vitezei și coordonatele în sistemele de echilibru.
Se pune întrebarea: moleculele se ciocnesc întotdeauna unul cu celălalt? La urma urmei, moleculele sunt foarte mici, iar distanțele dintre ele într-un gaz ideal sunt cu un ordin de mărime mai mare decât dimensiunile lor liniare. Poate, pentru navele de dimensiuni mici, zboară fără ciocniri de la perete la perete? Să presupunem de câte ori, pe unitatea de timp, o moleculă se poate ciocni cu ceilalți și ce distanță zboară în medie între coliziuni.
Înainte de a trece la calcule, vom adopta cel mai simplu model pentru molecule. Le vom reprezenta sub formă de bile elastice. În coliziunea moleculelor cu diametrele efective d1 și d2, centrele lor se apropie reciproc de o distanță (d1 + d2) / 2 (Figura 4.2).
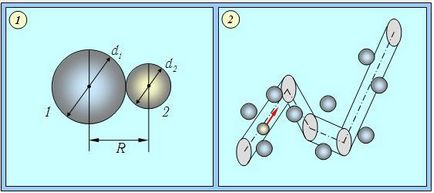
Fig. 4.2. Coliziunea a două molecule (1) și traiectoria moleculelor de gaz selectate (2) direcția de mișcare se schimbă atunci când unele dintre moleculele mediului intră în raza vzaimodeystviyaR = (dt + d2) / 2
Dacă ne imaginăm că molecula 1 este incidentă pe molecula 2, atunci se va produce o coliziune; Dacă prima moleculă intră într-o sferă de rază
descrise în jurul celei de-a doua molecule. Zona acestei sfere
Cantitatea R este numită raza efectivă de interacțiune dintre moleculele 1 și 2. a este secțiunea transversală efectivă pentru interacțiunea acestor molecule. În coliziunea moleculelor identice, d1 = d2 = d, R = d și
În timpul dintre două coliziuni succesive molecula zboară într-un fel. Desigur, pentru fiecare moleculă individuală este o chestiune de șansă pură, oricât de departe va reuși să avanseze fără coliziuni. Dar medierea calea l în toate moleculele sistemului, obținem o cantitate fizică
numita calea libera a moleculelor. Semnificația statistică a acestei cantități este după cum urmează: raportul unui segment mic de lungime dx k dă probabilitatea unei coliziuni
pe calea dx. Fie F (x) probabilitatea de a zbura pe o distanta x fara coliziuni. atunci
- probabilitate, zbor fără coliziune distanța x + dx. Ultimul eveniment este format din două evenimente independente:
particula a zburat fără coliziuni distanța x (probabilitatea căreia este P (x));
particula, de asemenea, fără coliziuni a depășit de asemenea un mic segment al căii dx (probabilitatea căruia este 1 - dx /). Prin teorema privind multiplicarea probabilităților, avem atunci
din care urmează ecuația pentru probabilitatea P (x)
Deoarece probabilitatea de depășire a unei distanțe zero fără coliziuni este unitatea, avem în plus condiția inițială P (0) = 1. Integrarea ecuației diferențiale, găsim în final
Nu trebuie să ne gândim, desigur, că probabilitatea depășirii distanței l fără coliziuni este zero: unele molecule pot zbura pe distanțe foarte lungi, dar numai o mică parte din ele. Pentru x =, după cum urmează din (4.1), probabilitatea unui pasaj fără coliziuni este
adică 63,2% din particule vor avea coliziuni de-a lungul acestei căi. Cu lungimea căii x = 2, obținem
adică 86,5% din particule sunt deja supuse coliziunilor, la x = 3 95% din particule participă la coliziuni, deoarece
Pentru a determina numărul mediu de coliziuni n dintr-o moleculă cu altele pe unitate de timp, se fac următoarele ipoteze:
toate moleculele sunt aceleași, adică nu considerăm amestecuri de gaze;
toate moleculele, cu excepția celei pe care o observăm, sunt imobile (în cele ce urmează vom arăta cum să scăpăm de această presupunere evident falsă);
în ciocnirile vitezei Comunicati a moleculei nu se schimbă (această ipoteză este în esență același nivel ca și cel anterior: o ciocnire elastică cu un obstacol, care rămâne staționar, viteza modulului nu se schimbă (semnificația subscript „din“ indicele va deveni clar mai târziu)) .
Calea diametrului nostru d moleculara este simplu, atâta timp cât ea nu a îndeplinit molecula fix al cărei centru ar fi pe linia de mișcare, la o distanță mai mică decât R = d. După aceasta, molecula va schimba direcția și se va deplasa rectiliniu până la o nouă coliziune. Pe durata intervalului de timp Δ t molecula va trece rupt calea Comunicati Δ t și se confruntă cu toate moleculele prinse în cilindrul spart de rază d și o suprafață a bazei = pd 2 (vezi. Fig. 4.1). Volumul acestui cilindru este pd 2 vOT Δ t. N- Dacă concentrația moleculelor din sistem (numărul pe unitatea de volum), este ușor de a găsi numărul de molecule încă în cilindru, adică, numărul de coliziuni DN:
Prin urmare, frecvența de coliziune (adică numărul de coliziuni pe unitate de timp)
Deoarece concentrația de particule la o temperatură constantă este proporțională cu presiunea, traiectoria medie liberă scade odată cu creșterea presiunii. Acest lucru este de înțeles, deoarece distanța medie dintre particule scade. De fapt, molecula nu este o minge solidă. Prin urmare, valoarea sa diametrului efectiv d nu este destul de constantă: scade odată cu creșterea temperaturii, deși nesemnificativ. Prin urmare, calea medie liberă crește ușor cu creșterea temperaturii.
Trebuie remarcat faptul că distanța medie dintre particule nu coincide cu calea medie liberă. Anterior, am estimat diametrul efectiv al moleculei de vapori de apă d = 3 × 10-10 m și distanța medie dintre molecule în condiții normale L = 3 × 10-9 m. De aceea, găsim concentrația de molecule
Înlocuind n găsită în expresia pentru calea medie liberă, găsim
Vedem că calea medie liberă este de 200 de ori mai mare decât diametrul moleculei și de 20 de ori mai mare decât distanța medie dintre molecule. Pentru completare, estimăm și frecvența de coliziune. Energia cinetică a mișcării translaționale a unei molecule
Cunoscând masa moleculei de apă
obținem estimarea vitezei rms
Cu alte cuvinte, molecula are 10 miliarde de coliziuni pe secundă! Dimensiunea liniară a unui vas care conține un litru de gaz este l = 10 cm = 0,1 m. La o viteză de 630 m / s, o moleculă ar putea zbura o cale de la perete la perete în timp
dar în acest timp va experimenta
coliziuni cu alte molecule.
Am plecat fără discuție prima presupunere despre similitudinea tuturor moleculelor. Nu era necesar din motive de principiu, ci pentru simplificarea derivării și a expresiilor finale. Dacă nu este cazul, dacă luăm în considerare un amestec de gaze, atunci componentele au diferite concentrații de particule, viteze diferite de rms și moleculele lor sunt mase diferite. Ca o consecință, formula pentru calea medie liberă se va schimba, iar rezultatele vor diferi pentru moleculele diferitelor soiuri.
Un exemplu. Ne găsim cum să schimbați cu formula (4.6) la calea medie liberă a moleculelor, în cazul în care acestea sunt discuri plate, care se deplasează într-un film subțire de material fiind în imposibilitatea de a zbura din ea?
Ca și înainte, pentru a se ciocni moleculele cu diametrele d1 și d2, trebuie să se apropie de distanță
Prin urmare, atunci când se deplasează pe planul filmului al moleculei ce atinge toate celelalte molecule, care intra în dreptunghiul rupte (în contrast cu cilindru în trei dimensiuni) lățime și lungime 2R Δ t Comunicati. Zona acestui dreptunghi
La o concentrație de suprafață a n molecule (în acest caz, n este numărul lor pe unitate de suprafață), vor exista coliziuni ΔN = Sn. Prin urmare, pentru frecvența de coliziune pe care o găsim
unde am ținut cont de faptul că, ca și înainte, viteza relativă
Prin urmare, calea medie liberă pentru moleculele plane care se mișcă în plan este egală cu
O dată în pădure, un arici în ceață și o bombă atomică. Ideea unei căi libere medii poate fi utilizată pentru a estima vizibilitatea într-o pădure, într-o ceață sau chiar pentru o estimare brută a masei critice de uraniu într-o bombă atomică.
Imaginați-vă că aveți o dată în pădure. Din ce distanță maximă R veți observa partenerul dvs. (și partenerul - dvs.)? Să presupunem că porniți lanterna pentru a-i da un semnal. Dacă nu luăm în considerare împrăștierea luminii, atunci toți copacii aruncă umbre a căror dimensiune liniară poate fi considerată aproximativ egală cu diametrul d al copacilor. În Fig. 4.3, locația dvs. este marcată cu un cerc roșu, în jurul unui cerc cu o rază de R, arborii sunt arătați cu cercuri verzi și umbrele lor pe cerc sunt marcate cu arc portocalii.
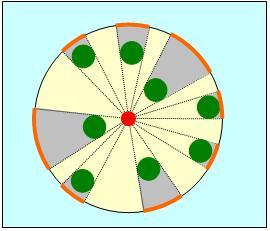
Fig. 4.3. Estimarea distanței maxime în pădure
Determinați ce parte din cerc este acoperită de umbre. Fie n densitatea plantării arborilor (numărul lor pe unitate de suprafață). Dacă l este distanța medie dintre copaci, atunci
În interiorul cercului există arbori pR 2 n. Lungimea totală a umbrei pe cerc este, prin urmare, pR 2 nd. Vedem că lungimea totală a umbrei crește ca un pătrat al razei și pentru o anumită valoare a lui R depășește circumferința lui 2pR. Dar dacă întregul cerc este acoperit de umbre, atunci lumina nu va merge mai departe. Această valoare a lui R este distanța maximă de vizibilitate din pădure. Acum este clar că este determinată de egalitate
adică, am obținut o estimare
Pentru un exemplu numeric, puteți lua valori pe baza experienței dvs. de viață. Spuneți, este dată o dată între copacii de mesteacăn cu un diametru mediu de tulpină d = 0,25 m și o distanță medie între arbori l = 10 m. Apoi găsim R = 800 m.
Să stabilim acum legătura dintre rezultatul obținut și formula pentru calea medie liberă. Noi o moleculă (fascicul de lumină) nu are dimensiunea (d1 = 0), mărimea altor molecule este egal cu diametrul mediu al cilindrului (d2 = d) și în final, moleculele (trunchiuri) - în repaus, adică este necesar să se debaraseze multiplicator. Ca rezultat, obținem, așa cum este aplicat problemei noastre, expresia
Astfel, am găsit raza de vizibilitate
Probabilitatea luminii de a depăși această distanță fără "coliziuni" cu copaci este
Cu alte cuvinte, cu o probabilitate de 86,5%, lumina va fi întârziată de copaci.
Întâlnirea din pădure a avut loc într-un avion. Acum ne vom întoarce în lumea voluminoasă. Aceeași figură prezintă acum o sferă cu raza R și obstacole în formă de bile cu diametrul d. De exemplu, dorim să evaluăm vizibilitatea unui arici, pierdut în ceață, iar rolul copacilor este acum jucat de picături de apă. Dacă concentrația picăturilor este n (numărul lor pe unitate de volum), atunci în interiorul sferei este
Umbrele lor pe sferă sunt cercuri cu o suprafață de 2/4 pd. La distanța maximă de vizibilitate, umbrele acoperă întreaga sferă:
De aici găsim distanța de vizibilitate în ceață
Din nou, comparați acest rezultat cu formula (4.6) pentru calea medie liberă a unei molecule într-un mediu gazos, unde este necesar să omiteți factorul și să luați
Probabilitatea de a depăși calea R = 3l fără coliziuni este
Prin urmare, cu o probabilitate de 95% de o coliziune pe această cale va avea loc.
Obținem o estimare numerică. Motivația noastră este potrivită dacă dimensiunea picăturilor este vizibilă (de exemplu, una sau două ordine de mărime) mai mare decât lungimea undei luminoase. Deoarece domeniul vizibil are lungimi de undă de 0,40-0,76 μm. atunci pentru diametrul picăturii se ia estimarea d = 10-4 m. Pentru concentrația picăturii se ia valoarea n = 3 × 10 7 m-3 (pentru originea acestui număr, vezi mai jos). Apoi va fi vizibilitatea în ceață
Concentrația de picături a fost estimată după cum urmează. Presiunea vaporilor de apă saturate, de exemplu, la 20 ° C (T = 293 K) este egală cu pH = 2,3 × 103 Pa. Aplicând ecuația Clapeyron-Mendeleyev, găsim densitatea vaporilor de apă la 100% umiditate:
Cu o scădere bruscă a temperaturii, tot aburul se condensează în picături de această dimensiune - se formează o ceață groasă. Masa unei picături este
Numărul de picături formate în volumul V se găsește ca raportul dintre masa vaporilor m și masa picăturii mCRAP. Apoi, concentrația picăturilor se determină din relație
Pentru d = 10-4 m, obținem valoarea n = 3 · 10 -7 m -3 folosită mai sus.
Dependența distanței de vizibilitate în ceață pe dimensiunea picăturilor este dată, prin urmare, de relația
La picături extrem de mici, cu un diametru de ordinul a 10 lungimi de undă d = 10 - 5 m, vizibilitatea este redusă la un metru. După cum se spune, "nu puteți vedea dincolo de nas". Cu dimensiuni chiar mai mici ale picăturilor, modelul nostru devine incorect, deoarece lumina nu mai poate fi văzută pur și simplu ca o colecție de particule cu o dimensiune neglijabilă. Efectele difracției încep să joace un rol și expresia pentru secțiunea efectivă a interacțiunii luminii cu picăturile nu va mai fi determinată de secțiunea pur geometrică a picăturilor.
Problema rezolvată are de asemenea legătură cu problema masei critice a uraniului-235 folosit pentru a face bombe atomice. În loc de lumină în această problemă, avem neutroni și în loc de picături - nucleul de 235 U. Atunci când ne confruntăm cu nuclei, neutronii le împărțesc în fragmente și, în același timp, sunt emise alte 3-4 neutroni. La o rază critică R, numărul de neutroni nu va scădea și va apărea o reacție în lanț auto-susținută - va apărea o explozie atomică. Ca bază pentru determinarea razei critice, putem lua raza de vizibilitate
redusă cu k ori (k = 3,5 - factor de multiplicare a neutronilor). Din moment ce
unde r0 = 1,4 · 10-15 m este raza nucleului cu numărul de masă A = 1. Acesta este protonul (neutronul). Prin urmare, diametrul efectiv al interacțiunii este
În cartea de referință (de exemplu, dicționarul enciclopedic rus) găsim densitatea uraniului rU = 19 · 10 3 kg / m 3. Masa nucleului uraniu-235 este determinată de masa protonului
De aici găsim concentrația de nuclei
Acum putem estima raza critică Rcrit
volumul critic Vcrit
și masa critică a lui Mkrite
Observăm că nu oferim niciun secret pentru producerea de arme nucleare: aceste estimări sunt prea nepoliticoase. Singurul nostru scop este să demonstrăm din nou unitatea legilor fizicii, care operează într-o mare varietate de sisteme.
Articole similare
Trimiteți-le prietenilor: