Circuite ritmice # 151; aceste fluctuații diurne ale diferiților parametri fiziologici și biochimici ai corpului, caracteristici pentru majoritatea ființelor vii, inclusiv pentru oameni. Practic, în fiecare organ al corpului nostru există celule care posedă un mecanism individual de "mecanism de ceas molecular". Momentele moleculare ale celulelor hepatice reglează producerea de diferite enzime necesare asimilării nutrienților. Un rol esențial în stabilirea acestor ceasuri este regimul alimentar. Oamenii de stiinta de cercetare recente de la Salk Institute sugerează că această setare este cel puțin parțial are loc prin intermediul adenozin-activat monofosfat protein kinazei (AMPK), care răspund la reducerea nivelurilor de ATP # 151; principalul suport energetic al celulei.
Te-ai gândit vreodată de ce dormem de obicei noaptea și lucrăm în timpul zilei? De ce în timpul zilei, după încă 3-4 ore de la ultima masă, începem din nou să suferim de foame și noaptea puteți dormi 8-10 ore la rând, fără să vă treziti pentru a vă reîmprospăta? De ce, după o trecere rapidă a mai multor fusuri orare într-un avion, suferim deseori de insomnie și tulburări digestive? Până în prezent, se știe că răspunsul la toate aceste "de ce" se află în ritmurile circadiene - fluctuațiile zilnice ale activității organelor corpului nostru.
La sfârșitul secolului trecut, oamenii de știință au aflat că în creierul mamiferelor există un "ceasornic" biologic care coordonează activitatea întregului organism. Mai precis, aceste ceasuri se află în nucleul suprachiasmatic (SCN) al hipotalamusului. SCN primește informații despre iluminare de la receptorii specifici localizați pe retina ochiului și trimite semnale adecvate către alte organe cu ajutorul hormonilor și impulsurilor nervoase. Mai mult - chiar mai interesant: se dovedește că unele celule ale SCN, precum și celule ale multor alte organe au un ceas molecular individual. "Gears" din acest ceas sunt factori de transcriere. a căror activitate se modifică pe parcursul zilei (figura 1). Sinteza unui număr de proteine diferite depinde de activitatea acestor factori cheie de transcripție, care generează ritmuri circadiane ale activității vitale a celulelor individuale și a organelor întregi. Lumina puternică, pornită la începutul nopții, este capabilă să miște ritmul circadian, activând transcripția genelor PER, care apare de obicei dimineața.
Fig. 1. Ceasul molecular al mamiferelor. În centrul ceasului sunt două proteine: CLOCK (CLK) și BMAL1. Dimerizarea, CLOCK și BMAL1 activează transcrierea genelor Period (PER) și Chryptochrome (CRY). rozătoare, Nocturnal precum și unele animale în timpul zilei, transcrierea genei și PER1 PER2 în SCN atinge apogeul în dimineața sau după-amiaza, și Cry1 și Cry2 - după-amiaza târziu. O creștere a concentrației de proteine PER și CRY în celulă declanșează un mecanism de feedback care blochează sinteza în continuare a acestor proteine. Conform studiilor recente, principalul inhibitor al complexului CLOCK-BMAL1 este CRY, dar acționează numai prin unificarea cu PER. În timpul nopții, enzimele celulare descompun treptat PER și CRY, iar când concentrația lor atinge un nivel critic scăzut, transcripția devine din nou activă. Timpul ciclului depinde de rata de degradare a PER și CRY. Imagine de pe Wikipedia.
Ronald M. Evans (Ronald M. Evans) și colegii săi de la Institutul American de Cercetare Biologică. Salk capabil să demonstreze că enzima sensibilă la prezența nutrienților - adenozin monofosfat (AMP), protein kinaza-activați (AMPK) -. Fosforileaza Cry1 proteine, promovând astfel descompunerea acesteia (Figura 2) [4]. Oamenii de știință au identificat doi aminoacizi în CRY1, fosforilarea cărora reduce în mod substanțial stabilitatea proteinei din cultura celulară, acestea sunt reziduurile serinei 71 (S71) și 280 (S280). Experimentele cu celule mutante care nu au forma activă de AMPK au demonstrat că această kinază fosforilează S71.
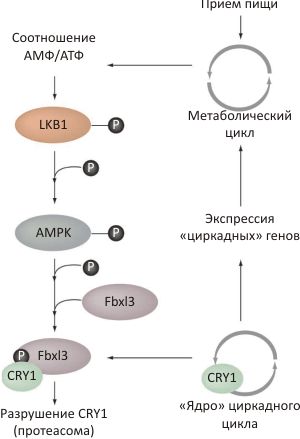
Figura 2. Interacțiunea ciclului metabolic și circadian. Procesele de biosinteză consumatoare de energie (anabolism) scad nivelul adenozin trifosfatului (ATP) cu o creștere simultană a nivelului de AMP din celulă. Creșterea raportului dintre AMP și ATP activează AMPK. AMPK activat, la rândul său, fosforilează CRY1, accelerând descompunerea sa și, prin urmare, aproximează reactivarea complexului CLOCK / BMAL1 și un nou stadiu al transcripției [3]. In ficatul șoarecilor și șobolanilor de reactivare a transcripției apare, de obicei, în a doua jumătate a zilei - adică, la sfârșitul unei perioade de repaus, atunci când rezervele de nutrienți acumulate în dimineața devreme, începe să vină la capăt. Imaginea de la [2].
S71 fosforilare îmbunătățește ubiquitylation (etichetarea specifică a proteinelor care urmează să fie distruse - vezi „Ubiquitous ubiquitin».) Cry1 și distruge simultan complexul Cry1-PER2. Chiar și înainte de aceasta, oamenii de știință știau că ubiquilizarea și degradarea CRY1 și CRY2 determină în mare măsură lungimea ciclului circadian [5]. Experimentele cu șoareci modificați genetic au confirmat relația dintre activitatea AMPK și ciclul circadian din ficat. Aceste rezultate sunt în concordanță cu modelul prezentat în Fig. 2. Cu toate acestea, există motive să se creadă că AMPK nu este singurul mecanism de comunicare între metabolism și ritmul circadian. În special, receptorii NADP / NADPH și receptorii nucleari pot juca, de asemenea, un rol important [1, 2].
La începutul articolului am menționat că oamenii într-un timp scurt, care traversează mai multe zone de timp, și în special cei care trebuie să o facă în mod regulat, de multe ori sufera de tulburari de somn si probleme digestive - asa-numitul „jet lag.“ Cauza întârzierii jetului este eșecul ritmurilor circadiene ale corpului. La șoareci, SCI poate intra într-un regim nou a doua zi după o schimbare de fus orar, dar durează aproximativ o săptămână pentru a reconfigura alte organe, în special ficatul. Astfel, există o desincronizare temporară a ritmurilor organelor individuale, care nu pot afecta decât munca lor. Eșecurile frecvente ale ritmurilor circadiene ale organelor digestive conduc în cele din urmă la o întrerupere a metabolismului și a obezității. Să sperăm că studiul suplimentar al ritmurilor circadiene va ajuta la găsirea unui mijloc care să faciliteze adaptarea organismului la schimbarea fusurilor orare.
Din cauza problemelor tehnice, astăzi mecanismul molecular al ritmurilor circadiene ale diferitelor organe a fost studiat în detaliu numai la șobolani de laborator și la șoareci, care au fost menționați de mai multe ori în acest articol. Cu toate acestea, este cunoscut faptul că dispozitivul ceasurilor moleculare ale celulelor umane și celulelor rozătoare este foarte similar, cel puțin în cazul celulelor pielii [6]. De asemenea, este interesant faptul că mutația genei PER2 umane provoacă un sindrom foarte rar al fazei timpurii de somn. la care oamenii se trezesc zilnic dimineața devreme, aproximativ 3-5 ore. Pentru a restabili forța lor la maxim, astfel de oameni sunt forțați să meargă la culcare prea devreme. Toate aceste fapte sugerează că există o puternică asemănare între oameni și rozătoarele de laborator în reglarea ritmurilor circadiene ale ficatului.
literatură
Articole similare
Trimiteți-le prietenilor: