Presiunea osmotică (indicată prin π) este presiunea hidrostatică excesivă asupra soluției. Se separă de un solvent pur printr-o membrană semipermeabilă. la care se încetează difuzia solventului prin membrană (osmoza). Această presiune are tendința de a egaliza concentrațiile ambelor soluții datorită difuziunii conjugate a moleculelor substanței dizolvate și a solventului.
Măsurarea gradientului de presiune osmotică, adică diferența în potențialul de apă al celor două soluții, separate de o membrană semipermeabilă, se numește tonicitate. O soluție care are o presiune osmotică mai mare decât cealaltă soluție se numește hipertonic, având o valoare hipotonică mai mică.
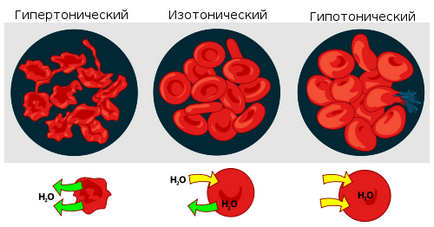
Interacțiunea eritrocitelor cu soluții depinzând de presiunea lor osmotică.
Dacă o astfel de soluție se află într-un spațiu închis, de exemplu, într-o celulă sanguină. atunci presiunea osmotică poate duce la ruperea membranei celulare. Din acest motiv sunt drogurile. destinate administrării în sânge, sunt dizolvate într-o soluție izotonică. conținând clorura de sodiu (NaCl), după cum este necesar pentru a echilibra presiunea osmotică a lichidului produs de celulă. În cazul în care medicamentele administrate au fost făcute în apă sau un foarte diluat (hipotonic în raport cu citoplasmă) soluție, presiunea osmotică, determinând pătrunderea apei celule sanguine ar duce la ruperea lor. În cazul în care intră în fluxul sanguin soluția prea concentrată de clorură de sodiu (3-10%, soluții hipertonice), apa din celulele vor merge spre exterior și se contractă. În cazul celulelor de plante, protoplastul este detașat de peretele celular. ceea ce se numește plasmoliză. Revers același proces are loc în sala de celule în soluție mai diluată ondulată, - respectiv deplazmolizom.
Amploarea presiunii osmotice create de soluția depinde de numărul, nu pe natura chimică a substanțelor dizolvate în ea (sau ioni. În cazul în care substanțele disociate molecule), prin urmare, presiunea osmotică a soluției este proprietatea colegial. Cu cât este mai mare concentrația substanței în soluție. cu atât este mai mare presiunea osmotică creată de ea. Această regulă, numită legea presiunii osmotice, exprimată într-o formulă simplă, care este foarte similar cu o anumită lege gaz ideal:
Aceasta arată, de asemenea, similaritatea proprietăților particulelor unei substanțe dizolvate într-un mediu vâscos de solvent cu particule de gaz ideal în aer. Validitatea acestui punct de vedere este confirmată de experimentele lui JB Perrin (1906): distribuția particulelor de emulsie de rășină gumigut în coloana de apă a fost, în general, subordonată legii lui Boltzmann.
Presiunea osmotică, care depinde de conținutul de proteine din soluție, se numește oncotică (0,03-0,04 atm). Cu foamete prelungită, boală de rinichi, concentrația proteinelor în sânge scade, scăderea tensiunii arteriale oncotice și apariția edemului oncotic. Apa trece de la vase la țesuturi, unde există mai mult de unul. În procesele purulente, SNCR în centrul inflamației crește de 2-3 ori, deoarece numărul de particule crește datorită distrugerii proteinelor.
În organism, presiunea osmotică trebuie să fie constantă (aproximativ 7,7 atm). De aceea, soluțiile izotonice sunt administrate pacienților (soluții, presiune osmotică care este egal πplazmy ≈ atm 7,7 (0,9% NaCl. - ser fiziologic, soluție de glucoză 5%) soluții hipertone în care π este mai mare decât πplazmy utilizat în medicină pentru .. răni de puroi (10% NaCl), de curățare pentru a îndepărta edemul alergic (10% CaCl2. 20% glucoză), ca un laxativ medicamente (Na2 SO4 ∙ 10H2 O. MgSO4 ∙ 7H2O).
Legea presiunii osmotice poate fi utilizată pentru a calcula greutatea moleculară a unei substanțe date (cu date suplimentare cunoscute).
Justificarea formulei Van't Hoff cu poziții termodinamice
În soluție, energia liberă este G = G 0 + R T ln x A + π V C + RTlnx +. unde x A este partea molară a soluției, V C> este volumul său molar. Apariția termenului π V C> este echivalentă cu introducerea presiunii externe în energia liberă. Pentru un solvent pur, G = G0>. La echilibru, ∇ G pentru solvent este zero. În acest fel,
0 = ∇ G = G 0 + R T l n x A + π V C - G 0 = R T l n x A + π V C. + RTlnx _ + \ pi V_-G ^ = RTlnx _ + \ pi V _,>
adică formula lui J. Vant-Hoff (π = cRT).
Când se deduce, se calculează că x B> este o valoare mică. Acest lucru ne permite să extindem ln (1 - x B))> într-un rând și apoi să aplicăm relația x B ≅ n B n A. \ cong >>> Produsul n A V C> în soluțiile diluate este practic egal cu volumul soluției.
Presiunea osmotică a soluțiilor coloidale
Pentru ca presiunea osmotică să aibă loc, trebuie îndeplinite două condiții:
- prezența unei membrane semipermeabile (membrană);
- prezența pe ambele părți a soluțiilor de membrană cu concentrații diferite.
Membrana este permeabilă la particule (molecule) de o anumită dimensiune, astfel încât ea poate, de exemplu, să treacă selectiv prin porii moleculele de apă, fără a trece moleculele de alcool etilic. Pentru un amestec de gaz - hidrogen și azot - rolul unei membrane semipermeabile poate fi realizat printr-o foaie subțire de paladiu prin care difuzează hidrogen liber, în timp ce practic nu trece prin azot. Cu ajutorul unei astfel de membrane, este posibilă separarea unui amestec de hidrogen și azot în componente separate.
Exemple simple și cunoscute de lungime de membrane care sunt permeabile la apă și impermeabile pentru multe alte substanțe dizolvate în apă sunt pielea, pergamentul și alte țesuturi de origine animală și vegetală.
Pfeffer cu un osmometru, în care a fost utilizată ca membrană semipermeabilă porțelan poros tratat cu Cu2Fe (CN) 6 Fe (CN). a investigat presiunea osmotică a soluțiilor apoase de zahăr din trestie. Pe baza acestor măsurători, Van't Hoff în 1885 a propus o ecuație empirică care respectă presiunea osmotică a soluțiilor diluate:
unde c = n / V este concentrația solutului, mol / m³.
Această ecuație în formă coincide cu legea Boyle-Marriott pentru gazele ideale. Prin urmare, presiunea osmotică a soluțiilor diluate poate fi definită ca presiunea care ar crea aceleași cantități de molecule ale substanței dizolvate dacă ar fi sub forma unui gaz ideal și ar ocupa un volum egal cu volumul soluției la o temperatură dată.
Ecuația lui Van't Hoff poate fi transformată într-o oarecare măsură, substituind în locul concentrației c i = n i / V = m i / M i V = n_ / V = m_ / M_V>:
unde m i> este concentrația de masă a substanței dizolvate; M i> este greutatea sa moleculară.
În această formă, ecuația Van't Hoff este utilizată pe scară largă pentru a determina masa molară a substanței dizolvate. Metoda osmotică este adesea utilizată pentru a determina masele molare ale compușilor cu înaltă moleculară (proteine, polizaharide și altele). Pentru aceasta, este suficient să se măsoare presiunea osmotică a unei soluții cu o concentrație cunoscută.
Dacă substanța se disociază într-o soluție dată, presiunea osmotică va fi mai mare decât cea calculată și trebuie introdus un coeficient izotonic:
Ecuația lui Van't Hoff este valabilă numai pentru soluții diluate care respectă legea lui Raoult. La concentrații mai mari ale soluției, c i> în ultima ecuație trebuie înlocuită cu activitatea a1> sau fugacitatea f 1.>
Rolul osmozelor în sistemele biologice
Fenomenul de osmoză și presiune osmotică joacă un rol imens în sistemele biologice care conțin septa semipermeabilă sub formă de țesuturi diferite, inclusiv membranele celulare. O osmoză constantă a apei din interiorul celulelor creează o presiune hidrostatică excesivă, care asigură forța și elasticitatea țesuturilor, care se numește turgor.
Dacă o celulă, de exemplu, o eritrocite, este plasată în apă distilată (sau o soluție de sare foarte diluată), atunci apa va pătrunde în celulă și celula se va umfla. Procesul de umflare poate duce la ruperea membranei eritrocitelor dacă apare o așa numită hemoliză.
Procesele de asimilare a alimentelor, metabolismul sunt strâns legate de permeabilitatea diferită a țesuturilor la apă și alte substanțe dizolvate în ea.
Tensiunea osmotică joacă rolul unui mecanism care alimentează celulele nutritive; la copacii înalți acestea cresc până la o înălțime de câteva zeci de metri, ceea ce corespunde unei presiuni osmotice de câteva zeci de atmosfere. Celulele tipice formate din saculete protoplasmice umplute cu soluții apoase de diferite substanțe (sap celular) au o valoare definită pentru presiune, valoarea căreia este măsurată în intervalul de 0,4-2 MPa.
Articole similare
-
Lămpi de sodiu din dunuri de înaltă presiune și pentru lampă umedă, magazin electric
-
Limiter - presiune - o enciclopedie mare de petrol și gaze, articol, pagina 3
Trimiteți-le prietenilor: