Malyugina O.V. Curs 3. Structura tabelului periodic Universitatea Mendeleev. Perioadele.
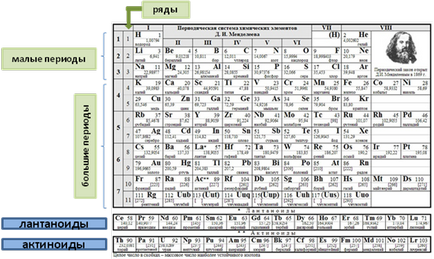
Versiunea scurtă a sistemului periodic constă în perioade, serii, grupuri și subgrupe.
În versiunea pe termen lung, rândurile nu sunt specificate.
Perioadă - rând pe orizontală a sistemului periodic al elementelor chimice, plasate la ordinea crescătoare a încărcăturii nucleului atomic, care începe cu un metal alcalin (Li, Na, K. Rb, Cs, Fr) și se termină cu un gaz inert (He, Ne, Ar, Kr, Xe, Rn ).
Excepții: prima perioadă, care începe cu hidrogen (nemetal).
Sistemul periodic are șapte perioade și zece rânduri.
Perioadele sunt împărțite în mici și mari.
Prima perioadă. care conține 2 elemente, precum și al doilea și al treilea. fiecare având 8 elemente în fiecare, sunt numite mici. Ele constau dintr-un rând orizontal.
Perioadele rămase, având două rânduri orizontale în fiecare, sunt numite mari.
A patra și a cincea perioadă conțin 18 elemente chimice fiecare. A cincea și a șasea perioadă - pentru 32 de elemente chimice. Cea de-a șaptea perioadă conține, conform ultimelor date, 32 de elemente, dintre care multe au fost obținute în mod artificial prin reacția de fuziune nucleară.
În fiecare perioadă mare există două rânduri.
Seria superioară de perioade mari este numită numere paralele. rândurile inferioare sunt ciudate. În chiar serii de perioade mari, există numai metale.
În a șasea perioadă după lantan La (numărul ordinal Z = 57) sunt 14 elemente (numărul ordinal Z = 58-71), care sunt similare ca proprietăți cu lantan și lantanide sunt numite, ele sunt situate în partea de jos a sistemului periodic.
În perioada șaptea neterminată a Ac după actinium (numărul ordinal Z = 89), există 14 elemente (numere de serie Z = 90 - 103), care sunt similare ca proprietăți cu anemone de mare și sunt numite actinide. La fel ca lantanidele, acestea sunt situate în partea inferioară a tabelului periodic (figura 1)
Fig.1. Aranjamentul perioadelor și seriilor
în sistemul periodic al D.I. Mendeleev
Tabelul 1. Numărul elementelor în perioade:
Regularitățile observate în perioade.
Fiecare perioadă (cu excepția primului) începe un metal tipic (Li, Na, K, Rb, Cs, Fr) și se termină cu gazul nobil (He, Ne, Ar, Kr, Xe, Rn), care este precedată de un tipic metaloid (F, CI, Br, I, At).
În fiecare perioadă, de la stânga la dreapta crește încărcătura nucleului atomic, raza atomică scade, există o slăbire a proprietăților nemetalice ale proprietăților oxidante amplificare, atenuare și elemente de restaurare de amplificare metalic și și formează compuși simpli și complecși.
Întrebări pentru încredere în sine
Ce elemente structurale conþine sistemul periodic de elemente chimice?
Care este perioada?
Câte perioade și serii în tabelul periodic?
Câte elemente în fiecare perioadă?
Ce perioade sunt numite mici și de ce?
Câte rânduri au perioade mici?
Ce perioade se numesc mari? Câte rânduri au perioade mari?
Ce caracteristici există în structura perioadelor VI, VII?
La ce elemente încep fiecare perioadă?
Ce elemente se termină în fiecare perioadă?
Ce elemente precede gazele nobile (inerte)?
Cum se schimbă proprietățile elementelor în perioade de la stânga la dreapta?
Din perioade, serii, grupuri și subgrupe.
Perioadă - rând pe orizontală a sistemului periodic al elementelor chimice, plasate la ordinea crescătoare a încărcăturii nucleului atomic, care începe cu un metal alcalin (Li, Na, K. Rb, Cs, Fr) și se termină cu un gaz inert (He, Ne, Ar, Kr, Xe, Rn ).
7 perioade și 10 rânduri.
Vezi tabelul 1.
Micile sunt numite perioade I, II și III, ele conțin, respectiv, 2, 8, 8 elemente chimice.
Perioadele mici au un rând. Vezi fig.1.
Mari sunt numite perioade IV, V, VI, VII. În fiecare perioadă mare există 2 rânduri. Vezi fig.1.
VI conține 14 elemente - lantanide, perioada VII conține 14 elemente de actinide. Pentru comoditate, acestea sunt situate în partea de jos a mesei.
Fiecare perioadă (cu excepția primei) începe cu un metal tipic alcalin (Li, Na, K, Rb, Cs, Fr)
Fiecare perioadă se termină cu un gaz nobil (He, Ne, Ar, Kr, Xe, Rn).
Acestea sunt precedate de non-metale tipice - halogeni (F, Cl, Br, I, At).
În fiecare perioadă de la stânga la dreapta, există o slăbire a metalelor și creșterea proprietăților nemetalice, o slăbire a reducerii și întăririi proprietăților oxidante ale elementelor și a substanțelor simple și complexe formate de ele.
Sarcini pentru soluții independente
În ce perioadă și serie sunt elementele cu numerele ordonale 14, 48, 52, 56, 78? Specificați simbolul lor, numele rusesc, masa atomică relativă.
Scrieți simbolurile, denumirile și masele atomice relative ale elementelor din seria ciudată a perioadei IV.
Ce element are proprietăți metalice mai pronunțate de calciu sau potasiu? De ce?
Ce element are mai multe proprietati nemetalice: fosfor sau clor? De ce?
Care element al perioadei a patra este cel mai activ non-metal? De ce?
Care element al celei de-a cincea perioade este cel mai activ metal? De ce?
3. Potasiu. Este necesar să se analizeze poziția elementelor din PCHE. Potasiul (K) și calciu (Ca) se află într-o (a patra) perioadă. În perioada de la stânga la dreapta, proprietățile metalului sunt slăbite.
4. Clor. Este necesar să se analizeze poziția elementelor din PCHE. Fosforul (P) și clorul (Cl) se află în aceeași perioadă (a treia). În perioada de la stânga la dreapta proprietățile nemetalice sunt amplificate.
5. Cel mai activ nonmetal al acestei perioade este bromul. În perioada de la stânga la dreapta proprietățile nemetalice sunt amplificate. Elementul inert al crisptului nu prezintă activitate chimică, este precedat de cea mai activă nemetalică.
6. Cel mai activ metal din această perioadă este rubidiul. Perioada începe cu un metal alcalin activ (Li, Na, K. Rb, Cs, Fr), în timp ce se deplasează de la stânga la dreapta în perioada respectivă, proprietățile metalului sunt slăbite.
Malyugina OV Lecture Structura tabelei periodice a lui DI Mendeleyev. perioadele
Numărul cursului 1. Definiția sistemului de operare, istoricul dezvoltării și scopului. (2 ore)
Compușii naturali și producția de fosfor
Rezumatul unei lecții generale despre chimie pe tema: Semnificația legislației periodice și a sistemului periodic
Instrucțiuni metodice la lucrarea de laborator "Structura și principiile organizării sistemului de fișiere ext2" în disciplină
Slavneft Yaroslavl Oil Refinery numit după. D. I. Mendeleev
Eseul meu mi sa părut interesant, pentru că este oxigen, ca nici un alt element din tabelul lui D. Mendeleyev nu este important pentru noi. Fără oxigen, viața de pe Pământ ar fi imposibilă. Oxigenul este cel mai frecvent element chimic din
Structura aproximativă a creditului de credit - modulul 2
Trimiteți-le prietenilor: