Legea periodică și sistemul periodic de elemente.
Familiile electronice ale elementelor și aranjarea lor în sistemul periodic Universitatea Mendeleev.
Schimbări periodice ale proprietăților elementelor și ale compușilor acestora.
DREPTUL PERIODIC ȘI SISTEMUL PERIODIC AL ELEMENTELOR.
Legea periodică a fost deschisă de Mendeleev în 1869. Legea stabilea relația dintre proprietățile elementului și greutatea atomică. Odată cu dezvoltarea mecanicii cuantice, legea periodică a primit o justificare teoretică riguroasă și o nouă formulare.
Proprietățile substanțelor simple, precum și formele și proprietățile compușilor, sunt dependente periodic de magnitudinea încărcărilor nucleelor atomilor lor.
O reprezentare grafică a legii periodice a lui Mendeleyev este numită sistem periodic de elemente.
Structura tabelului periodic.
Sistemul periodic al elementelor constă din perioade, grupuri și subgrupe. Perioada se numește numărul de serie al elementelor aranjate în ordinea crescătoare încărcare a nucleului atomilor, configurația de electroni, care variază de la 1 ns Dons 2 p 6 (ilins 2 din prima perioadă). Perioadele încep cu s-elemente și se termină cu un element p. (pentru prima perioadă -s-element). Perioadele mici conțin 2 și 8 elemente, perioade lungi de 18 și 32 de elemente, a șaptea perioadă rămâne incompletă.
Grupurile sunt rânduri verticale de elemente având aceeași configurație de electroni de valență. Există subgrupe principale (A) și subgrupuri (B) subordonate. Elementele situate în același grup au aceeași configurație a electronilor de valență, prin urmare, au proprietăți chimice similare. Ele sunt numite "elemente analogice".
Luați în considerare relația dintre poziția unui element într-un sistem periodic și structura electronică a atomilor acestuia.
FAMILII ELECTRONICE ALE ELEMENTELOR ȘI POZIȚIA LOR ÎNTR-UN SISTEM PERIODIC Mendeleev.
În funcție de subnivel de energie de coca umplut ultima, sunt 4 familii de elemente electronice: s, p, DIF, care ocupă o anumită poziție în sistemul periodic al elementelor.
1. Elementele s-sînt o familie de elemente în care, atunci când electronii umple nivelele electronice, ultimul electron ajunge la subsolul exterior. Ele se află în primul grup al subgrupului principal și în cel de-al doilea grup al subgrupului principal (El se referă și la ele). Numărul maxim de electroni pe s-subsub este de două, deci în fiecare perioadă există două s-elemente, iar la nivelul energiei externe au 1 sau 2 electroni.
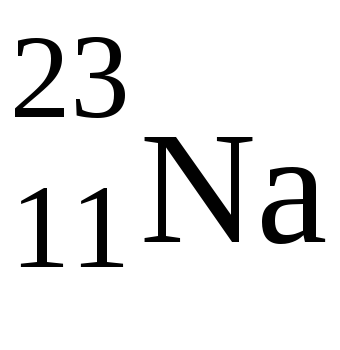
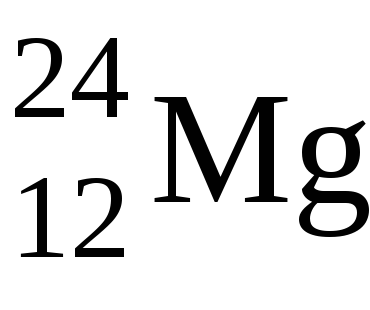
În acest caz, s-electronii, sau un electron, ai atomului Na și doi ai electronului la atomul de Mg vor fi valenți.
2. În p-elementele, ultimul electron ajunge la sub-nivelul nivelului exterior. Aceste elemente sunt situate de la III la VIII ale subgrupului principal al fiecărei perioade. Numărul lor în această perioadă este de 6, deoarece Numărul maxim de electroni perp-sublevel este de 6.
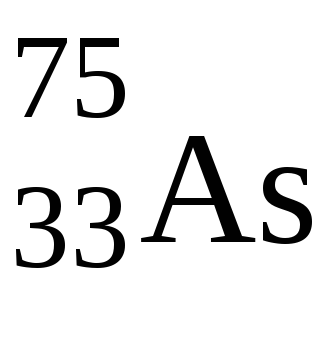
În acest caz, electronii de valență au o configurație de 4 s 2 p 3. Prin urmare, As poate fi oxidat de la -3 la +5. Gradul caracteristic de oxidare pentru acesta este de -3, +3, +5.
3. Elementele Ud zapolnyaetsyas stratul exterior primul subnivel iar acesta din urmă este un electron nad subnivel predvneshnego elemente urovnya.d-side sunt subgrupuri ale sistemului periodic. Elementele Ud-alunecare este posibil, cu nivel s electroni nivel predvneshnego orbital subnivelul exterior svobodnuyud dacă este energetic favorabil. Aceste elemente au la nivelul exterior 1 sau 2 electroni. Jumping dublu este observat în Pd, nu are electroni la nivelul exterior.
Numărul maxim de electroni pe d-subsol este de 10, deci din cea de-a patra perioadă a fiecărei perioade până la 10d elemente.
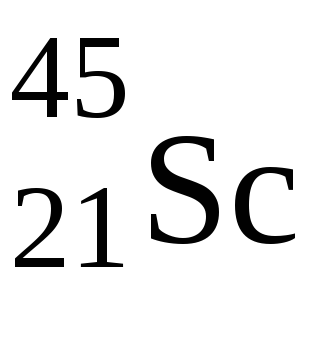
În acest caz, 4s-subsubul este umplut mai întâi, și numai apoi subsolul 3d. În acest element electronii de valență au configurația 3d 1 4s 2. De aceea, are un grad caracteristic de oxidare +3.
4. Elementele f sunt elemente care, la umplerea nivelelor electronice, ultimul electron ajunge la nivelul f-subsol al nivelului pre-exogen. Acestea includ lanthanoide și actinide.
Numărul maxim de electroni pe substratul f este de 14 ori, deci, în perioadele 6 și 7 ale sistemului periodic în ceea ce privește elementele 14f.
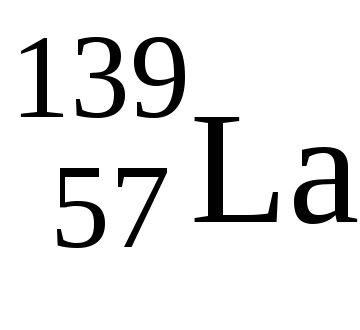
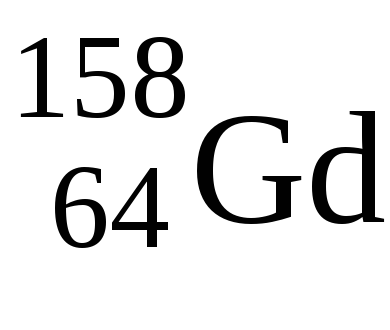
La Lavalentnye electronii au o configurație 5d 1 6s 2 - tipichnyyd-element de electroni de valență ca uGdkonfiguratsiya 5d 1 6s 2. Numai apoi umplute 4f-subnivel, astfel încât ambele elemente de starea de oxidare +3.
MODIFICAREA PERIODICĂ A PROPRIETĂȚILOR ELEMENTELOR ȘI A COMPUȘILOR LOR.
Conform formulărilor moderne ale legii periodice, proprietățile elementelor se află într-o dependență periodică de sarcina nucleară a tuturor atomilor.
Să luăm în considerare unele caracteristici ale elementelor.
Datorită naturii undelor electronului, atomul nu are limite clar delimitate, prin urmare conceptul dimensiunii atomului nu este strict și există mai multe metode de determinare a razei atomului. În prezent, se recomandă să se utilizeze raze orbitale pentru toate elementele cu o legătură metalică și covalentă. Raza orbitală. este distanța de la nucleul atomului la maximul funcției de distribuție radială a probabilității ultimei orbite atomice populate de electroni. De exemplu, pentru un atom de cupru, aceasta este distanța de la nucleul unui atom la maximul densității electronice a orbitalilor 4s.
Dependența radiațiilor atomice de încărcarea nucleului atomic are o natură periodică (Figura 12)
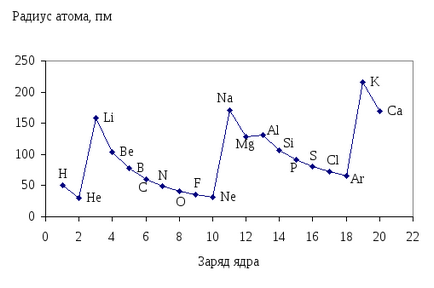
Fig. 12. Dependența radiațiilor orbitale ale atomilor de numărul ordinal al elementelor.
În perioada în care numărul atomic crește, dimensiunea atomului scade, deoarece încărcătura nucleului crește, iar numărul de niveluri de energie rămâne constant. Cu cat este mai mare sarcina nucleului, cu atat electronii sunt mai puternici atrasi de nucleu, ceea ce duce la o diminuare a dimensiunii atomului. Acest lucru este observat în mod deosebit în perioadele II și III.
Raza orbitală a atomilor de elemente din perioadele II și III (pm).
Această regularitate se explică prin creșterea numărului de cochilii de electroni și prin înlăturarea tot mai mare a electronilor externi din nucleu.
2. Energia ionizării.
energia ionizarea este numită energia necesară pentru a elimina un electron dintr-un atom, ion sau moleculă în faza gazoasă la t = 0 K fără a transmite electroni eliberat energia cinetică. Energia de ionizare este notată cu simbolul "Nion" și este exprimată în kJ, J sau eV.
1 eV este energia pe care un electron dobândește într-un câmp electric accelerator cu o diferență de potențial de 1 V (1 eV = 96,5 kJ)
Energia de ionizare exprimată în electron volți este numeric egală cu potențialul de ionizare al atomilor, exprimat în volți.
Potențialul de ionizare al atomilor unui element dat este cea mai joasă tensiune de câmp la care viteza electronului devine suficientă pentru ionizarea atomilor. Fiecare electron ulterior se detașează mai greu, adică N1 <Н2 <Н3 <…<Нn .
Cantitatea Nion caracterizează capacitatea unui element de a da electroni, adică caracterizează proprietățile sale de reducere. Nionul mai mic. cu atât sunt mai mari proprietățile de reducere a elementelor. În Fig. 13. Este prezentată dependența primei energii de ionizare a atomilor elementelor I-III de încărcăturile nucleelor atomilor lor.
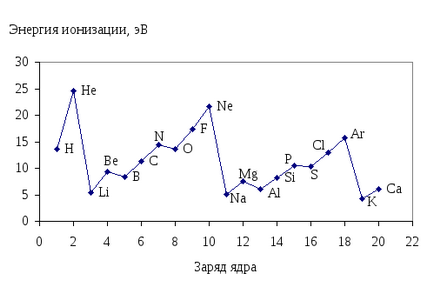
Fig. 13. Dependența primei energii de ionizare a atomilor de elemente din perioadele I-III asupra încărcărilor nucleelor atomilor lor.
Comparația datelor prezentate în Fig. 13 arată că cantitatea Nion este într-o dependență periodică de încărcăturile nucleelor atomilor elementelor.
În perioada cu o creștere a încărcării nucleului atomului, energia de ionizare crește și, în limitele grupului, scade.
Primele energii de ionizare ale atomilor elementelor grupurilor IA și IA, eV.
Cel mai puternic agent de reducere este Fr.
3. Energia afinității pentru electroni este energia care este eliberată atunci când electronii sunt atașați la un atom excitat, ion sau radical.
Această energie caracterizează proprietățile oxidante ale elementului, adică capacitatea de a atașa electroni.
În perioada cu o creștere a încărcăturii nucleului atomului, energia crește, iar în limitele grupului scade; raza atomului crește. Astfel, cu cât energia de afinitate este mai mare pentru un electron, cu atât este mai puternic oxidantul. Cel mai puternic oxidant este F.
Pentru a determina ce proprietăți sunt cele mai caracteristice pentru un element dat, definim electronegativitatea:
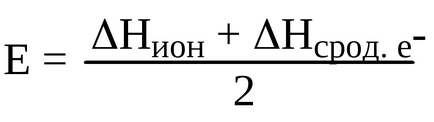
Prin definiție Pauling electronegativitate - capacitatea de atomi într-o moleculă sau ion complex pentru a atrage electroni care participă la formarea legăturii, adică de L. Pauling, elektrotritsatelnost se referă la atomii legați la moleculă. Pauling electronegativitate a introdus scara relativă, luând EO fluor egal cu 4. Termenul electronegativitatea cu creșterea responsabilă a nucleului atomilor este crescut, iar în cadrul unui grup - este redusă.
Electronegativitatea elementelor din perioadele II și III de Pauling (în unități relative)
Conform formulării legii periodice, nu numai proprietățile elementelor se schimbă periodic, ci și proprietățile compușilor lor în funcție de clase: oxizi, hidroxizi, compuși de hidrogen.
De exemplu, proprietățile acide și bazice ale oxizilor și hidroxizilor variază în funcție de schimbarea sarcinii nucleelor atomice ale elementelor.
În perioada, cu o creștere a încărcăturii nucleului atomilor, proprietățile de bază ale oxizilor și hidroxidurilor scad, iar proprietățile acide cresc. Luați, de exemplu, o perioadă:
NaOH-bază puternică
Mg (OH) 2 - bază slab solubilă
Al (OH) 3 - hidroxid amfoteric
H2O3 - acid slab
H3P04 este un acid de putere medie
H2S04 este un acid puternic
HClO4 este un acid foarte puternic
În grupuri cu o creștere a încărcăturii nucleului atomic, proprietățile de bază ale oxizilor și hidroxidelor sunt îmbunătățite, iar proprietățile acide sunt slăbite. De exemplu, luați în considerare un grup IVA:
H2S04 este un acid foarte slab
H2 GeO3 Ge (OH) 4 - hidroxid amfoteric cu predominanța proprietăților acide
Pb (OH) 4 - hidroxid amfoteric cu predominanța proprietăților de bază
Toți compușii chimici se formează datorită interacțiunii atomilor, care duc la o legătură chimică.
Articole similare
Trimiteți-le prietenilor: