Majoritatea reacțiilor chimice sunt reversibile: împreună cu o reacție directă (interacțiunea substanțelor inițiale), apare reacția inversă (interacțiunea produselor de reacție între ele). Deoarece fiecare reacție furnizează continuu reactivi pentru reacția din direcția opusă, niciuna dintre ele nu se oprește, iar întregul sistem ca întreg este dinamic. Într-o anumită perioadă de timp, ratele proceselor directe și inverse sunt egale - echilibrul chimic este stabilit în sistem. Echilibrul chimic este un echilibru dinamic, deoarece cu el apar două procese îndreptate opus, la rate egale.
Concentrațiile de substanțe aflate într-o stare de echilibru se numesc concentrații de echilibru, ele sunt interdependente - o schimbare în una dintre ele implică o schimbare imediată a celorlalte.
Studiile experimentale arată că pentru o reacție reversibilă a formei generale
într-o stare de echilibru, se face următoarea relație între concentrațiile echidistante de substanțe:
Această relație este o expresie matematică a echilibrului chimic al legii (legea acțiunii de masă). Acesta arată că produsul dintre concentrațiile de echilibru (în grade indici sunt egale cu raporturile stoechiometrice corespunzătoare) din materiile prime și produsele de reacție sunt conectate între ele printr-o valoare constantă K. numit echilibru chimic constant.
Sistemul chimic care a atins starea de echilibru va rămâne în el până când se vor schimba condițiile în care se stabilește acest echilibru. Modificarea stării de echilibru ca urmare a schimbărilor în condițiile externe se numește deplasarea echilibrului chimic. Dacă, ca urmare a unei schimbări a condițiilor externe, începe să predomine o reacție directă, atunci se spune că echilibrul sa schimbat spre dreapta. Dimpotrivă, accelerarea preferențială a reacției inverse este considerată ca o deplasare a echilibrului spre stânga.
În practică, schimbările de temperatură, presiune și concentrație de substanțe sunt cele mai des folosite pentru a schimba echilibrul chimic.
direcție de deplasare de echilibru prezis de principiul Le Chatelier lui. în cazul unui sistem în echilibru, au o influență externă (temperatura de schimbare, presiune, concentrația substanțelor), echilibrul se va deplasa spre fluxul reacției care slăbește acest efect.
Cu alte cuvinte, atunci când sistemul tinde să se întoarcă dezechilibru la o stare de echilibru (care este cea mai profitabilă energie), prin aceea că, în sistemul de livrare la orice efect care accelerează reacția, cursul dintre care cele mai contrapune un amestec din afară.
METODA EXPERIMENTALĂ ȘI PROCEDURA LUCRĂRII
Dispozitive, echipamente și reactivi
Termostat, baie de apă, termometru, cronometru, tuburi de test, pahar, pipete pentru 5ml și 10ml. Soluție 2% de acid sulfuric H2S04. Soluție 2% de tiosulfat de sodiu Na2S2O3. 2% soluție de amidon, soluții saturate de FeCI3, clorură de potasiu KCNS, clorură de potasiu KC1, sulfat de cupru CuSO4. Soluția Lugol (în picături).
Experimentul 1. Dependența ratei de reacție chimică la concentrația de substanțe care reacționează
Se va studia dependența ratei reacției chimice de concentrația substanțelor care reacționează pe interacțiunea tiosulfatului de sodiu cu acidul sulfuric:
Acidul tiosulfuric rezultat este instabil și ușor de descompus:
Pe scurt, procesul poate fi reprezentat după cum urmează:
Trecerea reacției poate fi judecată prin modificarea transparenței soluției. Ca urmare a reacției, se eliberează sulf liber, ceea ce provoacă turbiditatea acestuia.
Pentru a studia influența concentrației uneia dintre substanțele care reacționează asupra ratei acestei reacții, aceasta trebuie efectuată de mai multe ori, variind concentrația soluției unui reactiv inițial, dar lăsând concentrația celui de-al doilea reactiv constantă.
Schimbând concentrația de tiosulfat de sodiu, măsuram timpul din momentul drenării soluțiilor la începutul turbidității. Pentru acest interval de timp (τ) vom evalua rata relativă a reacției chimice.
În cinci tuburi, pipeta (10 ml), se iau 10 ml dintr-o soluție de acid sulfuric 2%.
În alte cinci pipete tuburi (5 ml) soluție de tip 2% tiosulfat de sodiu și apă în cantitățile indicate în tabelul 4 (a nu se confunda pipete!)
Fuzionarea soluțiilor preparate de tiosulfat de sodiu pereche și acid sulfuric într-un pahar de laborator, un cronometru, măsurați timpul de descărcare a soluțiilor înainte de turbiditate. timp record în tabelul 4. Soluția cu precipitatul se toarnă, din sticlă, se spală, se clătește cu apă distilată și cheltui în următorul experiment.
Se calculează ratele relative ale celor cinci reacții efectuate în conformitate cu formula:
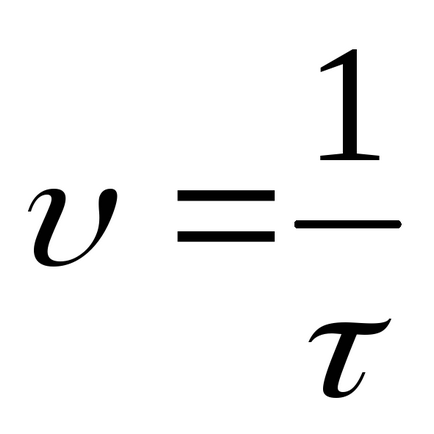
.
Înregistrați rezultatele experimentelor din Tabelul 1.
Se calculează concentrația relativă de Na2S2O3 prin formula
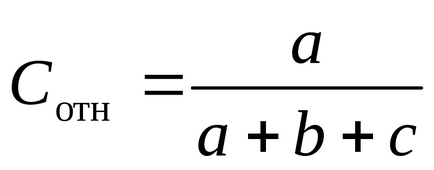
Înregistrați rezultatele experimentelor din Tabelul 1.
Construiți un grafic al ratei de reacție relativă față de concentrația relativă a Na2S2O3.
Faceți o concluzie cu privire la efectul concentrației asupra ratei de reacție. Observați caracterul dependenței ratei reacției date de concentrație (linia dreaptă care trece prin originea parabolei). Care este ordinea reacției studiate pentru acest reactiv? Faceți o concluzie generalizată cu privire la modul în care rata de reacție variază în funcție de concentrația substanțelor care reacționează.
Tabelul 1 - Rezultatele experimentelor pentru determinarea dependenței ratei de reacție chimică față de concentrația reactivilor inițiali
Experimentul 2. Dependența ratei de reacție chimică la temperatura substanțelor care reacționează
Dependența vitezei reacției chimice la temperatura substanțelor reactive va fi studiată pe aceeași reacție:
În acest caz, concentrațiile de tiosulfat de sodiu și acid sulfuric rămân neschimbate, iar temperatura la care se efectuează experimentul se modifică.
În două tuburi, se pipetează câte 5 ml de 15 ml soluție 2% de tiosulfat de sodiu Na2S2O3.
Se pipetează 10 ml în celelalte două tuburi și se toarnă 10 ml de soluție 2% de acid sulfuric H2SO4.
Două tuburi care conțin soluții de H2 SO4 iNa2 S2 O3 nagreytena baie de apă, în care temperatura apei diferită de la temperatura camerei până la 10 ° C (plus 2-3 ° C pentru tuburi de sticlă de încălzire și de dispersie).
Soluții încălzite, îmbinarea paharului, înregistrarea din momentul drenării soluțiilor la aspectul de turbiditate.
Repetați experimentul cu aceleași volume de reactanți utilizând următoarele două eprubete, dar la o temperatură de 20 ° C (plus 2-3 ° C) deasupra originalului. Înregistrați timpul până când soluția începe să cloud. Timpul de apariție a turbidității la temperatura camerei este luat din Tabelul 4 (experimentul 5).
Calculați rata de reacție relativă și coeficientul de temperatură al vitezei de reacție. Înregistrați rezultatele în Tabelul 2.
Pe baza datelor obținute, se trage o concluzie privind efectul temperaturii asupra vitezei de reacție. Cum se va schimba rata de reacție chimică cu creșterea temperaturii la fiecare 10 ° C?
Tabelul 2 - Rezultatele experimentelor pentru determinarea dependenței ratei de reacție chimică la temperatură
Experimentul 3. Dependența ratei reacției chimice la prezența catalizatorului
În reacția dintre tiocianat de potasiu și clorură de fier (III), se formează tiocianat de fier în roșu:
Când se adaugă tiosulfat de sodiu la fierul tiocianat, culoarea roșie dispare ca urmare a reacției:
Catalizatorul acestei reacții este ionii Cu2 +.
La 20 ml de apă într-un pahar mic, se adaugă 1-2 picături de soluții saturate de FeCl3 și KSNS. (Dacă soluția este foarte saturată, adică opacă, aceasta trebuie diluată cu apă până la o culoare roșie palidă).
Soluția rezultată este turnată în 2 tuburi de câte 7,5 ml fiecare.
În alte două tuburi, se toarnă 5 ml de soluție de tiosulfat de sodiu; în unul dintre ele se adaugă 2 picături de soluție de sulfat de cupru.
În primul tub de testare cu soluție de tiocianat de fier, se toarnă rapid o soluție de tiosulfat de sodiu, incluzând simultan un cronometru. Rețineți timpul în care dispare culoarea roșie.
În cel de-al doilea tub de testare cu soluție de tiocianat de fier, se toarnă rapid o soluție de tiosulfat de sodiu cu sulfat de cupru, incluzând simultan un cronometru. Rețineți timpul în care dispare culoarea roșie.
Calculați rata de reacție relativă conform formulei
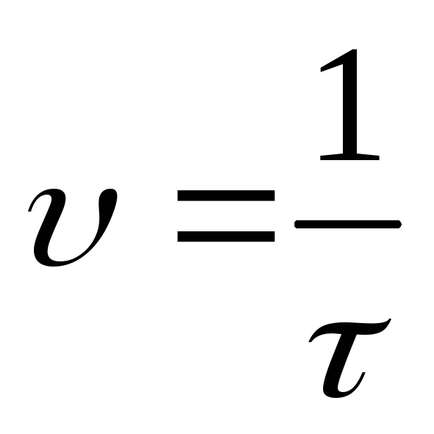
Înregistrați rezultatele în Tabelul 3.
Faceți o concluzie cu privire la efectul ionilor Cu 2+ asupra vitezei reacției.
Tabelul 3 - Rezultatele experimentelor pentru a determina dependența ratei de reacție chimică de prezența catalizatorului
Experimentul 4. Efectul temperaturii asupra deplasării echilibrului chimic
Efectul de concentrație asupra deplasării echilibrului chimic este convenabil studiat în reacția de formare a tiocanatului de fier (III) prin schimbarea culorii amestecului de reacție cu creșterea concentrației uneia dintre substanțele care reacționează:
fier tiocianat Fe (CNS) 3 intens colorate în culoare roșu închis, FeCl3 - galben, KSNSi KC1 - incolor, și la schimbarea kontsentratsiiFe (CNS) 3 culoare a modificărilor de soluție, care indică direcția de deplasare a echilibrului.
La 20 ml de apă într-un pahar mic, se adaugă 1-2 picături de soluții saturate de FeCl3 și KSNS. (Dacă soluția este foarte saturată, adică opacă, aceasta trebuie diluată cu apă până la o culoare roșie palidă).
Soluția rezultată este turnată în 4 tuburi.
În primul tub se adaugă câteva picături de soluție de FeCl3, al doilea - câteva picături de soluție KSNS, al treilea - KC1, al patrulea concediu pentru comparație. Observați rezultatele și înregistrați-le în Tabelul 4.
Explicați fenomenele observate folosind principiul Le Chatelier. Scrieți o expresie pentru constanta de echilibru. Faceți o concluzie generalizată cu privire la efectul unei modificări a concentrațiilor substanțelor inițiale și finale asupra poziției de echilibru.
Tabelul 4 - Rezultatele experimentelor pentru a determina efectul temperaturii asupra deplasării echilibrului chimic
Experimentul 5. Efectul concentrării asupra schimbării echilibrului chimic
Influența temperaturii asupra poziției echilibrului chimic este studiată prin reacția iodului cu amidonul cu formarea unei substanțe colorate în culoarea albă a unei compoziții complexe, pe care noi o numim în mod condiționat "amidon de iod":
În două eprubete, se toarnă 5 ml de soluție de amidon și se adaugă soluție de iod în picătură până când apare culoarea albastră.
Lăsați unul dintre tuburile de testare pentru comparație, o altă căldură. Rețineți schimbarea culorii.
Răciți tubul cu apă (sub robinet). Comparați culoarea în ambele tuburi de testare.
4. Explicați fenomenele observate folosind principiul Le Chatelier. Specificați direcția schimbării de echilibru, în funcție de creșterea sau scăderea temperaturii. Faceți o concluzie generalizată despre efectul temperaturii asupra poziției de echilibru.
Testați întrebările și sarcinile
Ce se înțelege prin viteza reacției chimice? Dați conceptul de rată medie și adevărată de reacție.
Care sunt principalii factori care determină rata de reacție?
Cum depinde rata de reacție de temperatura?
Cum depinde rata de reacție de concentrația reactanților? Care este ecuația cinetică?
Cum se determină experimental ordinea reacției pentru un reactiv dat?
Ce se înțelege prin reversibilitatea reacțiilor chimice?
Care este natura dinamică a echilibrului chimic?
Scrieți o expresie pentru constanta echilibrului chimic.
Cum se poate schimba direcția deplasării echilibrului chimic atunci când se schimbă condițiile de reacție (temperatură, presiune, concentrație de substanțe)?
Articole similare
-
Echivalența dinamică chimică - cartea de referință chimică 21
-
Simbolurile și formulele chimice sunt conceptele chimice de bază
Trimiteți-le prietenilor: