Compoziția nucleelor atomice. Izotopii (stabili și radioactivi)
Compoziția nucleelor atomice. Izotopii (stabili și radioactivi)
Atomii nucleului constau din protoni și neutroni. Numărul de protoni din nucleul Z determină sarcina pozitivă a nucleului, care este egală cu numărul de ordine al elementului. Prin urmare, numărul ordinal al elementului se numește numărul său de protoni. Masa relativă a nucleului constă dintr-o masă de protoni, care este de asemenea egală cu Z, iar masa de neutroni, în unități arbitrare egal cu numărul N. Deoarece neutroni aproape întreaga masă este concentrată în nucleul atomului, se poate presupune că greutatea atomică relativă egală cu suma maselor de protoni și neutroni: Ar = Z + N. Deoarece protoni și neutroni au un nume comun - nucleoni, masa atomică relativă determinată de numărul total de protoni și neutroni, și se numește numărul nucleon. Numărul de nucleoni (masa atomică relativă) și numărul de protoni (numărul de ordine) sunt notați cu indicii superior și respectiv inferior, respectiv în stânga simbolului elementului. De exemplu, din înregistrare, determinăm că numărul de protoni de oxigen este de opt, iar numărul nucleonic este de șaisprezece.
Să ne explicăm cum, folosind poziția elementului chimic în tabelul periodic, se poate determina numărul de particule elementare (electroni, protoni și neutroni) în atom. Gasim in tabelul periodic elementul chimic Aluminiu. Din celula intrările definesc acel număr secvență de aluminiu este 13, iar masa atomica relativa de 27. Prin urmare, sarcina atomului de aluminiu al nucleului este egal cu 13 (plus treisprezece). Nucleul atomului de aluminiu conține 13 protoni și 14 (27 - 13 = 14) neutroni. Spațiul din jurul nucleului este umplut cu 13 electroni.
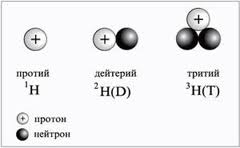
Diferitele tipuri de atomi au un nume comun - nuclide. Un nuclid este tipul de atomi cu anumite valori ale numerelor de nucleoni și protoni. Cele mai multe dintre elementele chimice găsite în natură constau în mai multe nuclide. Soiurile de atomi ai elementului chimic care are același număr de protoni dar numere diferite de neutroni și numărul deci nucleon (masa nucleului) se numesc izotopi. De exemplu, elementul chimic hidrogen are trei izotopi: protium
De exemplu, determinăm masa atomică medie a clorului natural, care există ca două izotopi: 35C1, 75,5% și 37C1, 24,5%. Pentru aceasta, folosim formula:
Toate izotopii sunt împărțiți în stabil și radioactiv. Izotopii stabili nu sunt supuși decăderii radioactive, deci sunt depozitați în condiții naturale. Izotopii stabili se găsesc în toate elementele "perechi" și în cele mai "ciudate", cu un număr de ordine mai mic sau egal cu optzeci și trei. În elementele situate în sistemul periodic după bismut, toate nuclidele sunt radioactive. Izotopii radioactivi sunt împărțiți în izotopi naturali și artificiali. Atât izotopii naturali cât și cei artificiali se descompun prin gravitate, emite particule α sau p până când se formează un izotop stabil. Proprietățile chimice ale tuturor izotopilor sunt în esență aceleași. Aceste proprietăți sunt determinate de sarcina nucleară și nu de masa ei.
Articole similare
Trimiteți-le prietenilor: