Hidrocarburile, în plus față de legăturile simple σ-carbon-carbon și carbon-hidrogen, au legături p-carbon, care sunt numite nesaturate. Deoarece formarea legăturii π este oficial echivalentă cu pierderea a doi atomi de hidrogen de către moleculă, hidrocarburile nesaturate conțin 2n mai puțini atomi de hidrogen decât cei limitatori, unde n este numărul de legături π:
O serie ale căror termeni diferă între ei prin (2H) n. se numește o serie izologică. Astfel, în schema de mai sus, izocianații sunt hexani, hexeni, hexadieni, hexine, hexatriene etc.
Hidrocarburile care conțin o legătură π (adică o dublă legătură) se numesc alchene (olefine) sau, pentru primul termen al seriei, etilenă, hidrocarburi etilenice. Formula generală pentru seria lor de omologie este CnH2n.
În conformitate cu regulile IUPAC atunci când se construiește denumirile alchenelor, cel mai lung lanț de carbon care conține o dublă legătură este numit alcanul corespunzător, în care capătul -an este înlocuit cu -en. Acest lanț este numerotat în așa fel încât atomii de carbon care participă la formarea dublei legături să obțină numere care sunt cel mai puțin posibil:
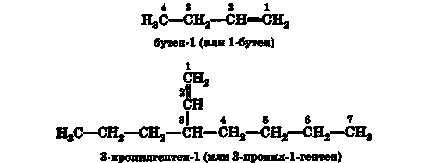
Radicalii sunt numiți și numerotați ca în cazul alcanilor.
Pentru alkenele cu o structură relativ simplă, este permisă utilizarea unor nume mai simple. Astfel, unele dintre cele mai frecvente alcene sunt numite prin adăugarea sufixului -en la numele unui radical hidrocarbonat cu același schelet de carbon:
Radicalii de hidrocarburi, formați din alchene, produc sufixul -enil. Numerotarea radicalului pornește de la un atom de carbon cu o valență liberă. Cu toate acestea, pentru radicalii alchenil simpli, în loc de denumiri sistematice, sunt permise nume triviali:
Atomii de hidrogen care sunt direct legați de atomii de carbon nesaturați care formează o dublă legătură sunt adesea numiți atomi de hidrogen din vinil,
În plus față de izomerismul scheletului de carbon, în seria de alchene este de asemenea izomerismul poziției de legătură dublă. În general, un izomerism al acestui izomerism de tip al poziției substituentului (funcției) - este observat în toate cazurile când există în grupa funcționale în moleculă. Pentru alcanul C4H10 sunt posibile două izomeri structurali:
Pentru alchenă C4H8 (butenă), sunt posibile trei izomeri:
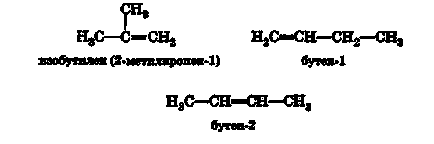
Butene-1 și butenă-2 sunt izomeri ai poziției funcției (în acest caz, rolul său este realizat printr-o dublă legătură).
Izomerii spațiați diferă în aranjamentul spațial al substituenților unul față de celălalt și se numesc izomeri cis dacă substituenții sunt localizați pe o parte a legăturii duble și izomerii trans, dacă sunt pe laturile opuse:
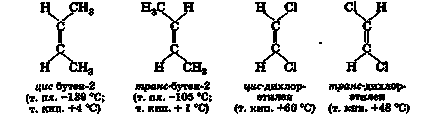
3. Structura dublei legături
Energia moleculei care rupe prin dubla legătură C = C este de 611 kJ / mol; deoarece energia σ-legătura C-C este egală cu 339 kJ / mol, energia ruperii legăturii π este de numai 611-339 = 272 kJ / mol. Electronii p sunt mult mai ușor de influențat de electronii p, de exemplu, prin solvenți polarizați sau prin reactivi care atacă. Acest lucru se explică prin diferența de simetrie a distribuției norului de electroni ai electronilor σ și π. Suprapunerea maximă a p-orbitalilor și, în consecință, energia liberă minimă a moleculei se realizează numai atunci când fragmentul de vinil este planar și la o distanță scurtă C-C egală cu 0,134 nm, adică mult mai mică decât distanța dintre atomii de carbon legată printr-o singură legătură (0,154 nm). Odată cu rotirea "jumătăților" moleculei relativ una de cealaltă de-a lungul axei dublei legături, gradul de suprapunere a orbitalilor scade, ceea ce este legat de consumul de energie. O consecință a acestui fapt este absența rotației libere de-a lungul axei duble de legătură și existența izomerilor geometrici cu substituție adecvată la atomii de carbon.
4. Proprietăți fizice
Ca alcanii, omologii inferiori ai unui număr de alkenuri cele mai simple în condiții normale sunt gazele și, din moment ce C5 - lichide cu punct de fierbere scăzut.
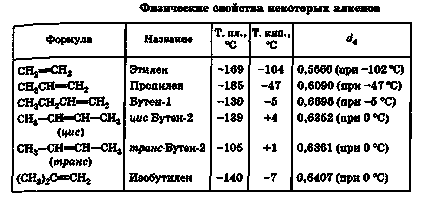
Toate alchenele, ca alcanii, sunt practic insolubile în apă și sunt ușor solubile în alți solvenți organici, cu excepția alcoolului metilic; toate au o densitate mai mică decât apa.
5. Proprietăți chimice
Atunci când se analizează reactivitatea compușilor organici complexi, funcționează un principiu general. În majoritatea reacțiilor nu participă un radical hidrocarbonat "inert", ci grupurile funcționale disponibile și cel mai apropiat mediu. Acest lucru este normal, deoarece majoritatea legăturilor sunt mai puțin durabile decât legăturile C-C și CH și, în plus, legăturile din grupul funcțional și în apropierea acestuia sunt cele mai polarizate.
Este natural să ne așteptăm ca reacțiile alchenelor să treacă printr-o dublă legătură, care poate fi de asemenea considerată ca o grupare funcțională și, în consecință, vor fi reacții de adiție și nu reacții de substituție care sunt caracteristice alcanilor considerați anterior.
Adăugarea hidrogenului la alchenă conduce la formarea de alcani:
Adăugarea de hidrogen la compușii de etilenă în absența catalizatorilor are loc numai la temperaturi ridicate, la care deseori începe descompunerea substanțelor organice. Este mult mai ușor să adăugați hidrogen în prezența catalizatorilor. Catalizatorii sunt metalele grupului de platină în stare fin dispersată, platina în sine și, în special, paladiul sunt deja la temperatura obișnuită. De mare importanță practică a fost descoperirea lui Sabatier, care a utilizat nichel fin divizat special, la o temperatură de 150-300 ° C, și în numeroase lucrări a arătat universalitatea acestui catalizator pentru o serie de reacții de recuperare.
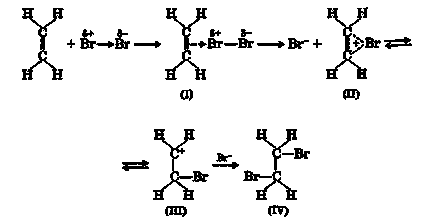
Halogenii sunt atașați la alchene prin formarea de derivați dihalogeni conținând atomi de halogen din atomii de carbon vecini:
În prima etapă a acestei reacții, se produce o interacțiune între electronii p ai dublei legături și particula de halogen electrofilă pentru a forma complexul π (I). Mai mult, complexul π este rearanjat într-un ion de oniu (bromiu) (II) prin despicarea anionului halogen, care este în echilibru cu carbocarea (III). Anionul atacă apoi ionul de onium pentru a forma un aduct (IV):
Articole similare
Trimiteți-le prietenilor: