Apa, fiind un electrolit foarte slab, disociază foarte puțin cu ionii:
Acest proces de echilibru este descris de constanta de echilibru:
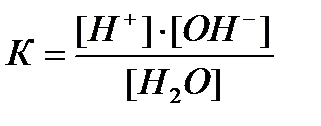
unde K este constanta de disociere a apei. La 22 ° C, este egal cu 1,8 # 8729; 10 -16.
Deoarece gradul de disociere a apei este foarte mic, în ecuația (1) concentrația de apă [H2O] poate fi considerată ca o constantă
,
unde Kw este produsul ionic al apei.
Înlocuind valorile K și [H2O] în ecuația (2), obținem valoarea numerică a produsului ionic de apă la 22 ° C.
Kw = [H +] [OH-] = 1,8 # 8729; 10 -16 # 8729; 55,56 = 10-14
Dependența KW de temperatură este demonstrată de următoarele date:
t, C 0 10 22 30 50 100
KW 0,36 × 10 -14 1,00 × 10 -14 1,89 × 10 -14 5,6 × 10 -14 74 × 10 -14
Astfel, KW este o valoare constantă numai la o anumită temperatură.
Soluțiile în care concentrațiile de ioni de hidrogen și ioni de hidroxid sunt aceiași se numesc soluții neutre. La 22 ° C în soluții neutre, concentrația ionilor de hidrogen și a ionilor de hidroxid este de 10-7 moli / litru. În soluțiile acide, concentrația de ioni de hidrogen este mai mare, în soluții alcaline concentrația de ioni de hidroxid. Dar indiferent de reacția soluției, produsul concentrațiilor de ioni de hidrogen și de ioni de hidroxid rămâne constant.
Rezultă că gradul de aciditate și gradul de bazicitate al soluției pot fi exprimate folosind concentrațiile de ioni H + sau OH:
Soluție neutră [H +] = 10 -7 mol / l,
Soluția acidă [H +]> 10 -7 mol / l,
O soluție alcalină de [H +] <10 -7 моль/л.
Pentru a evita inconvenientele asociate cu utilizarea numerelor cu exponenți negativi, concentrația de ioni de hidrogen este exprimată de obicei în termeni de indice de hidrogen și indicată prin simbolul pH-ului.
PH-ul este logaritmul zecimal al concentrației de ioni de hidrogen, luați cu semnul opus:
pH = -lg [H +] sau [H +] = 10-pN
unde [H +] este concentrația de ioni de hidrogen, mol / l.
Indicele de hidroxil pOH este logaritmul zecimal al concentrației de ioni de hidroxid luați cu semnul opus:
pOH = -lg [OH-] sau [OH-] = 10-POR
unde [OH -] - concentrația de ioni de hidroxid, mol / l.
pH + pOH = 14; pOH = 14 - pH.
Relația dintre concentrația de ioni de hidrogen, valoarea pH-ului și reacția soluției pot fi arătate clar în schemă

Se poate vedea din schemă că cu cât pH-ul este mai mic, cu atât este mai mare concentrația ionilor de H +. și anume aciditatea mai mare a mediului; și invers, cu cât pH-ul este mai mare, cu atât concentrația ionilor de H + este mai mică. adică, alcalinitatea mediului este mai mare.
Articole similare
Trimiteți-le prietenilor: