PENTRU PROFESORII ȘCOLILOR SECȚIUNI,
STUDENȚI DIN UNIVERSITATEA PEDAGOGICĂ ȘI ȘCOLII DE SCHIMB 9-10 CLASE,
DUMNEAVOASTRĂ PENTRU REDUCEREA CHIMIEI ȘI A ȘTIINȚEI NATURALE
TASTE DE LABORATOR DE TEXT PRACTICI DE LABORATOR Povești științifice pentru citire
§ 6.1. Soluții, concentrație, solubilitate
Există substanțe cu capacitate nelimitată de a se dizolva unul în celălalt (de exemplu, acid sulfuric și apă sau alcool etilic și apă) și cu o capacitate limitată. Pentru caracterizarea cantitativă a unei substanțe, solubilitatea este limitată la dizolvarea în altă substanță. care este exprimată prin concentrația unei soluții saturate.
Se obține o soluție saturată atunci când dizolvarea ulterioară a unei componente date în soluție încetează. Într-o soluție saturată, concentrația acestei componente este maximă în condițiile date. Soluția saturată trebuie să fie întotdeauna în echilibru cu componenta cristalină (sediment). Concentrația acestei componente în soluție se numește solubilitatea acesteia. O soluție în care concentrația acestei componente este mai mică decât solubilitatea sa este denumită nesaturată.
O soluție în care concentrația de substanță dizolvată este mai mare decât solubilitatea sa se numește suprasaturate. Astfel de soluții se obțin, de obicei, prin răcirea superioară a soluției sub temperatura la care devine saturată.
Uneori se spune despre dizolvarea metalelor, de exemplu sodiu în apă sau zinc în acid sulfuric. Dar noi vom numi dizolvarea doar un astfel de proces, în care substanța dizolvată poate fi izolată de soluție în starea ei inițială prin operații simple, cum ar fi evaporarea solventului, recristalizarea, etc.
Solubilitatea este în mod convenabil exprimată în mol / l, indiferent cât de des se exprimă ca procent din masă, adică numărul de grame de substanță dizolvată în 100 g dintr-o soluție saturată. Uneori, solubilitatea se exprimă prin numărul de grame de substanță dizolvată pe 100 g de solvent.
Soluția
Se determină masa de apă în 10 g soluție saturată de NaCI. Luăm masa de clorură de sodiu în această soluție pentru x g, apoi masa de apă va fi (10 - x) g.
Să facem o paritate:
Prin urmare, 100 / (10-x) = 31,6 / x. și x = 2,4 g de clorură de sodiu. Masa apei din această soluție este de 10 - 2,4 = 7,6 g.
Pentru majoritatea substanțelor, solubilitatea este dependentă în mare măsură de temperatură. Tabelele de referință sau curbele de solubilitate sunt utilizate pentru determinarea solubilității la temperaturi diferite (Figura 6.1).
Dacă pregătiți o soluție saturată la o temperatură de t2. conținând m2 g de substanță per 100 g de apă și apoi se răcește la o temperatură de t1. la care solubilitatea este de 1 g, se precipită un precipitat (cu condiția să nu se formeze nici o supracolă sau o soluție suprasaturată) cu o masă (m2-ml) g.
Câte grame de azotat de potasiu se vor precipita atunci când soluția de azotat de potasiu saturat în apă la 60 ° C este răcită la 20 ° C (a se vedea figura 6.1)?
Solubilitatea substanțelor suficient de solubile este determinată cel mai ușor prin evaporarea unei anumite cantități de soluție și cântărirea masei reziduului uscat.
Un exemplu. Se calculează solubilitatea azotatului de potasiu în apă la temperatura obișnuită (20 ° C), dacă, prin evaporarea a 50 g soluție saturată, greutatea sării uscate este de 13,02 g.
Soluția
Greutatea de azotat de potasiu în 100 g de soluție egală cu 13,02 • 100/50 = 26,04 Această masă de nitrat de potasiu per 100 - 26,04 = 73,96 grame de apă într-o soluție saturată. Facem raportul:
De unde x = 26,04 • 100 / 73,96 = 35,2 g. Aceasta este solubilitatea, adică masa substanței dizolvate în soluție saturată, pe 100 g de apă.
Pe diferitele solubilități ale substanțelor, una dintre metodele de purificare a acestora se bazează pe recristalizare. Purificarea este redusă la dizolvarea substanței contaminate într-un solvent adecvat la o temperatură ridicată și apoi la separarea cristalelor substanței care trebuie purificată din soluția suprasaturată la o temperatură mai scăzută.
Uită-te la Fig. 6.1. Ce substanțe pot fi purificate prin recristalizare? Poate această metodă să fie utilizată pentru purificarea clorurii de sodiu?
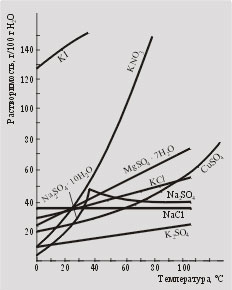
Fig. 6.1.
Curbele de solubilitate ale substanțelor
în apă la diferite temperaturi
Soluția saturată, care rămâne după separarea cristalelor precipitate, se numește regală. Unele impurități pot fi îndepărtate din precipitat. Când recristalizarea se repetă, puritatea substanței crește.
Solubilitatea substanței este, în esență, constanta de echilibru a procesului eterogen al tranziției materiei de la faza cristalină la soluție. În acest sens, din valorile de solubilitate la două temperaturi, este ușor să se calculeze schimbările de entalpie (efect termic) și entropia după dizolvare.
Fie ca solubilitatea substanței la P2 să fie P2. iar la T1 solubilitatea este egală cu P1. Compunem un sistem de două ecuații cu două necunoscute (H și S):
Apoi calculați H și S.
Un exemplu. Solubilitatea clorurii de argint în apă la 10 ° C este de 6.083.10-6 mol / l,
și la 25 ° C - 1,249 • 10-5 mol / l. Calculați schimbarea entalpiei și a entropiei la dizolvarea clorurii de argint:
Soluția
Compunem un sistem de două ecuații:
Din prima ecuație găsim:
și înlocuiți-o în a doua ecuație:
Astfel, am obținut o schimbare de entropie pozitivă la dizolvarea clorurii de argint, ceea ce indică faptul că tranziția de clorură de argint de la starea cristalină la soluție (sub formă de ioni de argint și ioni de clor), are loc creșterea gradului de dezordine în sistem.
Gasim schimbarea entalpiei, substituind valoarea lui Spar = 19.06 J / (K • mol) intr-una din ecuatii, de exemplu:
Gross = 27,997,048 + 298,2 • 19,06 = 33,681 J / mol.
Atunci când clorura de argint este dizolvată în apă, se absorbă 33,68 kJ de căldură pentru 1 mol din această substanță.
Compoziția chimică a apelor naturale joacă un rol imens în viața umană. Pentru a face diverse băuturi
Este nevoie de apă care are niveluri strict definite de substanțe dizolvate.
Substanțele absolut insolubile nu există în natură. Chiar și cea mai pură apă de pe Lacul Baikal conține săruri care sunt spălate din roci și soluri care curg în lac de râuri. Ploaie și apă de zăpadă topită - nu apă complet curată, dar apă conținând 10-20 mg de substanțe dizolvate pe 1000 g de apă. Cu toate acestea, o astfel de apă poate fi utilizată în scopuri tehnice atunci când este necesară apă distilată, de exemplu, pentru prepararea unei soluții de acid sulfuric pentru o baterie de mașină.
Dacă apa este ținută într-un vas de argint pentru o vreme, bacteriile aproape mor în apă. Argila metalică se dizolvă în apă, iar ionii de argint au un efect bactericid puternic. În condiții de mars, este util să beți apă dintr-o sticlă de argint (argintiu). Folosind tacâmuri de argint atunci când mănânci este de asemenea foarte util. Dezinfectează apa și clorura de argint, deși este practic insolubil în apă. Astfel de soluții pot fi tratate cu răni mici.
Apele naturale diferă în ceea ce privește compoziția și cantitatea de substanțe dizolvate.
Concentrația substanțelor organice în apa râului este de aproximativ 20 mg / l, în ocean - aproximativ 4 mg / l.
Lista surselor de substanțe organice din apele naturale.
Nu încercați să vă amintiți datele numerice, care vor fi date mai jos. Încercați să comparați compoziția unor ape.
Compoziția chimică a apei lacului Baikal (mg / l):

Apa lacului Baikal este ca apa distilată. Observați cât de puțini ioni de clor, ioni de fier în această apă! Încercați să explicați de ce există foarte mulți ioni de bicarbonat și ioni de calciu în apa Baikal.
Japonia a oferit în mod repetat să cumpere apă Baikal și să construiască o conductă pentru acest lucru.
Unele informații despre Lacul Baikal. Vârsta orașului Baikal este de aproximativ 25 de milioane de ani. Baikal este cel mai adânc iaz pe glob, situat pe continent. Adâncimea maximă este de 1620 m. Volumul lacului este de 23 000 km 3. Apele Baikal sunt transparente până la 40 m. Baikal conține 1/5 din rezervele de apă dulce din lume.
Lacul care conține sare anorganică într-o cantitate de peste 35 g / l se referă la mineral. O soluție saturată a acestor lacuri se numește saramură. Datorită viscozității mai mare de înaltă distribuție a căldurii apei de suprafață, în adâncimea apei este dificilă, astfel încât stratul superior al apei în vara poate fi încălzit la o temperatură de 50 ° C, apa din timpul iernii nu poate îngheța chiar și la -20 ° C,
Lacul Baikal poate fi în contrast cu alte lac de renume mondial - Marea Moartă (Israel, Iordania) lângă Ierusalim. Compoziția sărurilor predomină clorura de magneziu (52%) și clorură de sodiu (30%) sunt, de asemenea, clorură de potasiu și prezente bromură de magneziu. Desigur, toate aceste substanțe în soluția apoasă sunt prezente ca ioni, dar când spunem „clorură de magneziu“ „clorură de sodiu“ și alte săruri, se înțelege sărurile formate prin evaporarea apei. Din cauza salinitate ridicată de la Marea Moartă apele nu organismele vii, cu excepția unor bacterii (conservate din cele mai vechi timpuri). apa din Marea Moartă și coasta noroi au proprietăți medicinale ridicate. aerul de mare este saturat cu vapori de brom și iod.
Imaginați-vă că lucrați într-o agenție de resort. Trebuie să știți care sunt stațiunile care tratează aceste boli sau alte boli. Aceasta se referă la compoziția apelor minerale. Ce spui persoanei care vrea să meargă la Pyatigorsk sau Kislovodsk? Sau, poate, este mai bine să nu mergeți departe, ci să beți apă minerală "Moscova"?
Compoziția apei minerale "Moscova" (g / l):
Comparați compoziția apei minerale "Moscova" cu compoziția apei din Lacul Baikal. Pentru a face acest lucru, găsiți aceleași ioni și exprimați concentrațiile în aceleași unități de măsură.
Kislovodsk este renumit pentru sursele sale de narzan. Mai jos este compoziția chimică a lui Narzan (g / l) dintr-o sursă din Kislovodsk:
Care este diferența dintre apa "Narzan" și apa minerală "Moscova"?
Lista de concepte și cuvinte noi și uitate
soluție;
faze de compoziție variabilă;
solvent;
o substanță dizolvată;
fracție de masă;
concentrație procentuală;
molar, concentrație molară;
concentrația normală;
solubilitate;
soluții saturate, nesaturate, suprasaturate;
recristalizare;
mamă;
apele naturale proaspete și sărate.
Trimiteți-le prietenilor: